微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,下列说法中正确的是( )
A.R是第三周期元素
B.RO3-和NO3-均只能被还原,不能被氧化
C.R元素的最高正价与N元素最高正价相同
D.R和N两元素的单质都是空气的主要成分
参考答案:酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,则R比N多10个电子,R的原子序数为17,应为Cl元素,则
A.R为Cl元素,原子序数为17,原子核外有3个电子层,应位于周期表第三周期,故A正确;
B.ClO3-中Cl元素的化合价为+5价,处于中间价态,既具有氧化性,又有还原性,故B错误;
C.Cl元素的最高正价为+7价,N元素的最高正价为+5价,二者不同,故C错误;
D.氮气为空气的主要成分,氯气有毒,不能大量存在于空气中,故D错误.
故选A.
本题解析:
本题难度:一般
2、填空题 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:______;
(2)周期表中最活泼的非金属元素位于第______族;
(3)所含元素种类是8种的周期是第______、______周期.
参考答案:(1)质子数为8的原子为氧原子,则含8个质子、10个中子的原子的质量数=8+10=18,化学符号为188O,
故答案为:188O;
(2)非金属强的元素在元素周期表中的右上方的位置,在每个周期中第ⅦA族元素的非金属性最强,在第ⅦA族中Cl元素的非金属性最强,故答案为:ⅦA;
(3)短周期包括一、二、三周期,第一周期有2种元素,第二、三周期都含有8种元素,故答案为:二;三.
本题解析:
本题难度:一般
3、选择题 下列说法错误的是
[? ]
A、含有共价键的化合物一定是共价化合物
B、在共价化合物中一定含有共价键
C、含有离子键的化合物一定是离子化合物
D、双原子单质分子中的共价健一定是非极性键
参考答案:A
本题解析:
本题难度:简单
4、填空题 随着科学的发展,科学家们合成了一些氙的化合物。请回答下列问题。
(1)Xe原子的价电子排布式为_________。稀有气体中只有密度较大的氙能合成出多种化合物,其原因是____________。
A.氙含量比较丰富B.氙原子半径大,电离能小C.氙原子半径小,电离能大
(2)研究报告指出:“关于XePtF6”的化合价有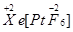 、
、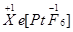 两种可能,经证实
两种可能,经证实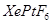 不溶于
不溶于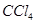 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定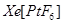 中化学键类型为________。
中化学键类型为________。
(3)金属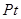 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
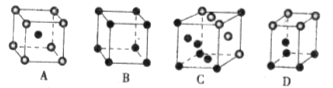
已知金属Pt的密度为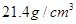 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
(4)氙的含氧化合物主要有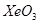 和
和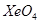 ,它们都有很强的氧化性,
,它们都有很强的氧化性,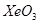 的分子构型是__________,
的分子构型是__________,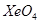 中Xe原子的杂化类型是_______,与
中Xe原子的杂化类型是_______,与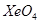 分子互为等电子体的离子有___________(填一种)。
分子互为等电子体的离子有___________(填一种)。
参考答案:(1)5s25p6(1分)B(1分)
(2)离子键、配位键(2分)
(3)C(1分),139(4分)
(4)三角锥形?sp3?SO42—(或PO43—、ClO4—等)
本题解析:(1)Xe为54号元素,根据核外电子排布规律其价电子排布式为5s25p6;稀有气体中只有密度较大的氙能合成出多种化合物,其原因是:A、 氙为稀有气体,含量比较少,错误;B、 氙原子半径大,电离能小,正确;C、 氙在稀有气体中原子半径较大,电离能较小,错误,选B。(2)根据相似相溶原理,XePtF6不溶于CCl4等非极性溶剂,XePtF6具有较强的极性,其化学键类型为离子键和配位键;(3)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,选C;(4)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,XeO4分子中含有4个δ键,为正四面体型分子,杂化方式为sp3杂化;根据等电子体的概念知,与XeO4互为等电子体的微粒有SO42—、PO43—、ClO4—等。
本题难度:一般
5、选择题 有关化学用语正确的是( )
A.乙烯的最简式-CH2-
B.硝基苯的分子式C6H6NO2
C.HCl的电子式是
D.CCl4的电子式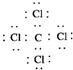
参考答案:A.乙烯中C、H原子个数的最简比为1:2,则最简式为CH2,故A错误;
B.硝基苯的分子式C6H5NO2,故B错误
C.HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为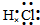 ,故C错误;
,故C错误;
D.CCl4为共价化合物,各原子均满足最外层8电子稳定结构,电子式为 ,故D正确;
,故D正确;
故选D.
本题解析:
本题难度:简单