微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,发生的反应:2MnO4- +16H+ + 10Cl- ="==" 2Mn2+ + 5Cl2↑ + 8H2O.现有一个氧化还原反应中,已知反应物和生成物有KCl、H2SO4、KMnO4、MnSO4、H2O、K2SO4、Cl2
(1)已知该反应中,KMnO4得到电子,写出一个包含上述七种物质的氧化还原反应方程式(不需要配平)?;则反应的还原剂为??
(2)上述反应中,1mol氧化剂在反应中得到?电子
(3)如果在反应后的溶液中加入NaBiO3,溶液又变回紫红 色,请判断下列正确的是
色,请判断下列正确的是
A.氧化性:BiO3->MnO4->Cl2
B.氧化性:BiO3->Cl2>MnO4-
C.氧化性:MnO4->BiO3->Cl2
D.氧化性:Cl2>MnO4->BiO3-
参考答案:(1) KCl + KMnO4 + H2SO4? ?MnSO4 + K2SO4 + Cl2↑ +H2O ;? KCl
?MnSO4 + K2SO4 + Cl2↑ +H2O ;? KCl
(2) 5mol ; (3) A
本题解析:略
本题难度:一般
2、选择题 符合如下图中阴影部分的物质是
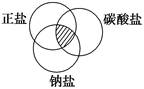
A.Na2CO3
B.Cu2(OH)2CO3
C.NaCl
D.NaHCO3
参考答案:A
本题解析:考查物质的分类:交叉分类法
其中NaCl为正盐、钠盐;NaHCO3为碳酸盐、钠盐;Cu2(OH)2CO3为碱式盐、碳酸盐;
而Na2CO3符合题意,属于正盐、钠盐及碳酸盐
本题难度:简单
3、选择题 下列有关化学用语错误的是
A.乙醇分子球棍模型: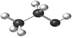
B.聚乙烯的结构简式 n
n
C.-OH的电子式: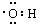
D.CH4Si的结构式: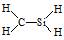
参考答案:D
本题解析:略
本题难度:一般
4、填空题 (6分)由稀有气体元素Xe(氙)形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入30 mL Mn2+浓度为0.1 mol·L-1的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56 mL,在反应过程中溶液的pH不断减小。
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为____________。
(2)试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为____________。
参考答案:(6分)(1)+7 (2)5XeO3+6Mn2++9H2O="5Xe+6" MnO4-+18H+ (3)1
本题解析:(1)XeO3中Xe的化合价是+6价,产物中的Xe的化合价是0价,化合价降低,所以Mn元素的化合价应该升高,56 mLXe的物质的量是0.056L/22.4L/mol=0.025mol,则转移电子的物质的量是0.025mol×6=0.015mol,Mn2+的物质的量是0.03L×0.1 mol·L-1=0.003mol,设Mn元素升高后的化合价是x,根据得失电子守恒得0.015=0.003(x-2),x=7,所以氧化产物中锰元素的化合价为+7价;
(2)XeO3与Mn2+反应后的产物中有Xe单质,+7价Mn对应的离子是MnO4-,反应过程中溶液的pH不断减小,说明有氢离子生成,所以反应的离子方程式为5XeO3+6Mn2++9H2O="5Xe+6" MnO4-+18H+ ;
(3)Mn2+的物质的量是0.03L×0.1 mol·L-1=0.003mol,则生成氢离子的物质的量是0.009mol,则氢离子的浓度为0.009mol/0.09L=0.1mol/L,所以溶液的pH=1.
考点:考查氧化还原反应的判断与分析计算
本题难度:一般
5、选择题 下列有关化学用语表示正确的是
A.对硝基甲苯的结构简式:
B.镁离子的结构示意图:
C.次氯酸的电子式:
D.亚硫酸钠水解的离子方程式:SO32- +2H2O H2SO3+2OH-
H2SO3+2OH-
参考答案:A
本题解析:A、硝基和甲基处于苯环的对位,正确;B、镁离子第3层电子已失去,错误;C、次氯酸分子O原子分别与H原子和Cl原子形成一对共用电子,错误;D、SO32?分步水解:SO32?+H2O HSO3?+OH?,错误。
HSO3?+OH?,错误。
本题难度:一般