|
高中化学知识点大全《离子方程式的书写及正误判断》高频试题巩固(2017年最新版)(六)
2017-03-05 13:24:40
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式,书写正确的是( )
A.Al2(SO4)3 =2Al3+ + 3SO42-
B.AlCl3 = Al3+ +Cl-
C.Mg(NO3)2 = Mg+2 +2NO3-
D.KMnO4 =K+ +Mn7+ +4O2-
|
参考答案:A
本题解析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式。B不正确,应该是AlCl3=Al3++3Cl-;C不正确,应该是Mg(NO3)2= Mg2++2NO3-;D不正确,应该是KMnO4=K++MnO4-,答案选A。
考点:考查电离方程式的正误判断
点评:该题是基础性试题的考查,难度不大。书写电离方程式时应特别注意:①写出物质正确的化学式是正确书写电离方程式的基础。②要正确书写出电离的阳离子、阴离子的符号。③含有原子团的物质电离时,原子团应作为一个整体,不能分开。④表示离子数目的数字要写在离子符号的前面,不能像在化学式里那样写在右下角。⑤在电离方程式中,阴阳离子所带正负电荷的总数必须相等。
本题难度:简单
2、填空题 (13分)研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2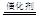 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为________________.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol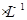 的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。 的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
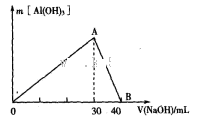
请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________.
②实验中需配制1.0 mol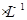 的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。 的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
③写出图中A→B反应的离子方程式:_______________________。
④通过计算,该废水中______Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________(若不含有,此问不必作答)。
参考答案:17、(1)NO2 1 (2)2CO+2NO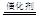 N2+2CO2 (3)①Fe3+ 、Na+、OH-;②100ml容量瓶 N2+2CO2 (3)①Fe3+ 、Na+、OH-;②100ml容量瓶
③Al(OH)3+4OH-=AlO2-+2H2O ④含有 0.1mol/L
本题解析:(1)反应CH4+2NO2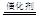 N2+CO2+2H2O中甲烷中碳元素的化合价由-4价生成到CO2中的+4价,失电子,作还原剂,NO2中氮元素化合价由+4价降低到0价,得电子,作氧化剂,标况下11.2L甲烷的物质的量为0.5mol,消耗NO2 1mol; N2+CO2+2H2O中甲烷中碳元素的化合价由-4价生成到CO2中的+4价,失电子,作还原剂,NO2中氮元素化合价由+4价降低到0价,得电子,作氧化剂,标况下11.2L甲烷的物质的量为0.5mol,消耗NO2 1mol;
(2)将CO和NO转化为参与大气循环的无毒气体,该气体是氮气,该反应的化学方程式为2CO+2NO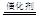 N2+2CO2 N2+2CO2
(3) Fe3+黄色,某无色废水中一定没有Fe3+,钠的焰色为黄色,进行焰色反应实验,火焰为无色,一定没有Na+,向废水中加入足量的BaCl2溶液,生成2.33g白色沉淀,一定含有SO42-,根据溶液呈电中性,一定有Al3+,铝离子与OH-不能大量共存,一定没有OH-,①该废水中一定不含有的离子是Fe3+ 、Na+、OH-;②配制溶液需要的仪器有托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶和胶体滴管,所以除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有100ml容量瓶,③图中A→B是氢氧化铝沉淀溶解的过程,反应的离子方程式为Al(OH)3+4OH-=AlO2-+2H2O ④根据题意2.33g硫酸钡沉淀的物质的量为0.01mol,则SO42-的物质的量为0.01mol,根据图像Al3++3OH-=Al(OH)3,消耗氢氧化钠30mL,物质的量为0.03mol,则Al3+物质的量为0.01mol,根据溶液呈电中性,一定有Cl-,物质的量为0.01mol,则c(Cl- )=0.01mol/0.1L=0.1mol/L。
考点:考查氧化还原反应的计算,化学方程式的书写,离子共存的判断与计算。
本题难度:一般
3、填空题 在氧化还原反应中,氧化剂 电子,发生的反应是 反应;
还原剂 电子,发生的反应是____________反应。
铁与氯气反应的化学方程式为 ,生成物中铁是 价,铁与盐酸反应的离子程式为 ,生成物中铁是_____价。
参考答案:得到 还原 失去 氧化 2Fe+3Cl2=2FeCl3 +3 Fe+2H+=Fe2++H2↑ +2
本题解析:氧化还原反应中,氧化剂是化合价降低、得到电子、发生还原反应、生成物是还原产物;还原剂是化合价升高、失去电子、发生氧化反应、生成物是氧化产物。氯气表现强氧化性,能把变价金属氧化为最高价,即2Fe+3Cl2=2FeCl3,其中FeCl3中Fe的价态+3,铁与盐酸的反应,利用H+的弱氧化性,把铁单质氧化为Fe2+。
考点:考查氧化还原反应等相关知识。
本题难度:一般
4、填空题 把CO2通入浓的NaOH溶液中,反应开始时反应的离子方程式为 ;若继续通入CO2直至过量,则有细小晶体析出,其反应的化学方程式为 ;
然后将析出晶体后的溶液分成2等份,分别滴入少量下列溶液,反应的离子方程式为:
⑴NaOH溶液: ;
⑵HCl溶液: 。
参考答案:CO2+2NaOH=Na2CO3+H2O CO2+NaOH= NaHCO3或 Na2CO3+H2O + CO2 = 2NaHCO3
HCO3-+ OH- = CO32- + H2 O
HCO3-+ H+= CO2+H2 O
本题解析:略
本题难度:一般
5、填空题 离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图.下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________.

(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O===2NaOH+H2↑).
| 错误观点
| 离子方程式
| ①
| 所有的离子方程式均可以表示一类反应
|
| ②
| 所有酸碱中和反应均可表示为:H++OH-===H2O
|
|
参考答案:(共8分,每空2分)
(1) C A B (2)AgCl
(3)
错误观点
离子方程式
①
所有的离子方程式均可以表示一类反应
2Na+2H2O===2Na++2OH-+H2↑
②
所有酸碱中和反应均可表示为:H++OH-===H2O
2H++SO+Ba2++2OH-===BaSO4↓+2H2O
本题解析:(1)所有的置换反应全是氧化还原反应,是被包含和包含的关系,故A是氧化还原反应,B是置换反应, C是离子反应。
(2)根据离子反应的条件可知,沉淀向更难溶的方向移动,所以将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀,说明AgCl的溶解度大于AgBr的溶解度。
(3)①有的离子反应只表示一个化学反应,比如2Na+2H2O=2Na++2OH-+H2↑。
②H++OH-=H2O只表示强酸和强碱反应生成可溶性的盐和水的反应,比如硫酸和氢氧化钡之间的反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O。
考点:本题考查离子反应的概念、条件和实质。
本题难度:一般
|