微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 I. 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)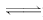 CH3OH(g).
CH3OH(g).
根据题意和所给图象完成下列各题:反应达到平衡时,平衡常数表达式K=?,
(2)升高温度,K值??(填“增大”“减小”或“不变”).
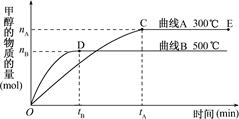
II. 可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2?(填大或小);(2)(a +b)比(c +d)?(填大或小);
(3)温度t1℃比t2℃?(填高或低);(4)正反应为?反应。
参考答案:I(1) (2)减小?II(1)小(2)小?(3)高(4)放热
(2)减小?II(1)小(2)小?(3)高(4)放热
本题解析:I.(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知平衡常数表达式K= 。
。
(2)根据图像可知,温度越高,甲醇的物质的量越少,这说明升高温度平衡向逆反应方向移动,所以升高温度平衡常数减小。
II(1)压强为P2时首先达到平衡状态,所以压强 P1比P2小。
(2)压强高,反应物的转化率低,这说明增大压强平衡向逆反应方向移动,所以正方应是体积增大的可逆反应,则(a +b)比(c +d)小。
(3)温度为t1时首先达到平衡状态,则温度t1℃比t2℃高。
(4)温度高反应物的转化率低,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确反应速率和平衡常数的含义以及影响因素,然后依据图像和方程式灵活运用勒夏特列原理判断即可。有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力。
本题难度:一般
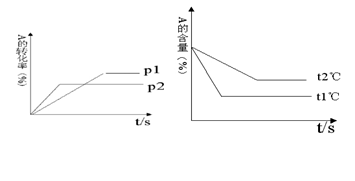
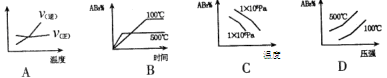
2、选择题 对于可逆反应2AB3(g)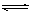 A2(g) +3B2(g)(正反应吸热)下列图像正确的是
A2(g) +3B2(g)(正反应吸热)下列图像正确的是
参考答案:B
本题解析:从方程式可看出:该可逆反应的正反应是一个气体体积增大的吸热反应。根据勒夏特列原理:增大压强,化学平衡向逆反应方向移动;升高温度,化学平衡向正反应方向移动。升高温度,化学反应速率加快,达到化学平衡需要的时间就越少。A图可逆反应达平衡后升高温度,由于V(逆)>v(正),化学平衡向逆反应方向移动,这与题目中正反应吸热相违背。错误B升高温度,化学平衡向正反应方向移动,反应物的转化率越高,达到平衡时它的含量就越少,正确C增大压强,化学平衡向逆反应方向移动, AB3应该越多,但选项中压强高时反应物的在平衡时含量反而少,错误。D图 升高温度,平衡时反应物的含量就越高,这与化学平衡在升温时向正反应方向移动相违背,错误。
本题难度:一般
3、填空题 某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:?
?
实验
序号
|  浓度 浓度
时间
温度
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.5 0 0
| 0.50
|
2
| 800℃
| 1.0
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是?min,实验4达到平衡的时间是?min,C3??1.0 mol?L-1(填“< ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率?(填“快”或“慢”),原因是?。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,??放出的热量多,理由是?。
参考答案:(1)40?、? > ?
(2)快?、?温度较高。
(3) 4 、反应的量较多
本题解析:略
本题难度:简单
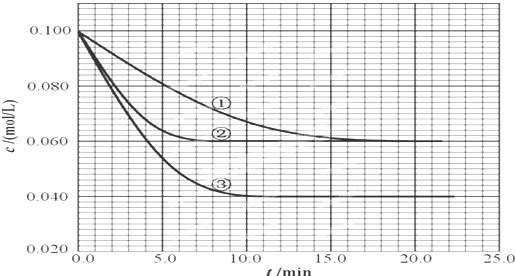
4、简答题 在2.00L的密闭容器中,反应2A(g)?B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L.反应物A的浓度随时间的变化如下图所示:
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:______(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=2v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为______,B平均反应速率为______.
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______.
(4)实验①条件下该反应的化学平衡常数值是______.若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028molB和0.028molC,求新平衡时体系中A的物质的量浓度.(写出计算过程)
参考答案:(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故错误;
②任何时候,v(A)=2v(B),不能作为判断达到平衡的依据,故错误;
③反应前后气体的化学计量数之和相等,压强不可作为判断的依据,故正确;
④A的质量分数不再改变,能作为判断达到平衡的依据,故正确;
⑤任何时候,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以不能作为判断达到平衡的依据,故错误;
故选:④;
(2)实验②平衡时B的转化率为0.04mol/L0.1mol/L%=40%;
2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
4.0min(mol/L) 0.06 0.04 0.04
则B平均反应速率为0.02mol/L4.0min=0.005mol/(L?min),
故答案为:40%;0.005mol/(L?min);
(3)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:加催化剂;温度升高;
(4)2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
平衡(mol/L) 0.06 0.04 0.04
平衡常数表达式K=C(C)C(B)C2(A)=0.04×0.040.062=49;
往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A(g)?B(g)+C(g)
旧平衡(mol/L)0.0600.0400.040
新起始(mol/L)0.0600.040+0.0140.040+0.014
转化(mol./L)2xxx
新平衡(mol/L)0.060+2x0.054-x0.054-x
K=(0.054-x)2(0.060+2x)2=49 x=0.006mol/L;
再次达到平衡时A的物质的量浓度:c(A)=(0.060+0.006×2)mol/L=0.072mol/L;
故答案为:49;0.072mol/L.
本题解析:
本题难度:一般
5、选择题 两气体A、B分别为0.6mol、0.5mol。在0.4L密闭容器中发生反应:3A+B mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是?(?)
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是?(?)
A.m值为3 ?
B.B的转化率为20%?
C.A的平均反应速率为0.1mol·L-1·min-1?
D.平衡时反应混合物总物质的量为1mol
参考答案:B
本题解析:3A+B mC+2D
mC+2D
n始? 0.6mol、0.5mol? 0? 0
n变?0.3mol? 0.1mol? 0.1m? 0.2mol
n平?0.3mol? 0.4mol? 0.1m? 0.2mol
0.1m? =? 0.2mol? m=1B的转化率为20% ,A的平均反应速率为0.15mol·L-1·min-1? ,B 正确。C错误。平衡时反应混合物总物质的量为1.1,mol,D错误。
本题难度:简单