微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ( 12分)
(1)二甲醚燃料电池的正极反应式为?。电池在放电过程中,负极周围溶液的pH?。(填“增大”、“减小” 或“不变”)
(2)以上述电池为电源,通过导线电解池相连。两极为石墨,电解质溶液为1L
0.1mol/LKCl溶液,写出电解总反应的离子方程式为?。
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到右图(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
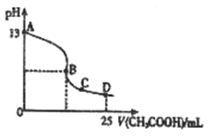
①若图中的B点pH=7,则滴定终点在?区间(填 “AB”、“BC”或“CD”)。
B点溶液中离子浓度大小为??。
②D点溶液中C(HAc)??C(Ac_ )(填> 、< 或= )。
参考答案:(12分)(1)O2+4H++4e-=2H2O?减小
(2)2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
(3)①AB? c(CH3COO-)=c(K+>c(H+)=c(OH-)? ②<
本题解析:(1)原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应。再氧气在正极通入,二甲醚在负极。所以正极的电极反应式是O2+4H++4e-=2H2O,负极电极反应式是CH3OCH3+3H2O=2CO2+12e-+12H+,因此电池在放电过程中,负极周围溶液的pH减小。
(2)惰性电极电解氯化钾溶液时,阳极是氯离子放电生成氯气,阴极是氢离子放电生成氢气,所以总的反应式是2Cl-+2H2O H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。
(3)①醋酸是弱酸,因此当醋酸与氢氧化钾恰好反应时,生成的醋酸钾水解,溶液显碱性。由于B点pH=7,所以滴定终点在AB之间;溶液显中性,根据电荷守恒定律可知,此时在B点离子浓度大小顺序是c(CH3COO-)=c(K+>c(H+)=c(OH-)。
②根据图像可知,氢氧化钾的浓度是0.1mol/L,所以D点溶液中含有的溶质是醋酸和醋酸钾。由于溶液显酸性,这说明醋酸的电离程度大于醋酸钾的水解程度,因此c(HAc)<c(Ac_)。
本题难度:一般
2、填空题 已知下列热化学方程式:①H2(g) +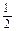 O2(g)=H2O(l) ΔH="-285" kJ·mol-1
O2(g)=H2O(l) ΔH="-285" kJ·mol-1
②H2(g) +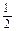 O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1 ③C(s) +
O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1 ③C(s) + O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH="-393.5" kJ·mol-1 回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧1gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
参考答案:(1)285 393。5
(2)142.5
(3)CO(g)+ O2(g)=CO2(g) ΔH="-283" kJ·mol-1
O2(g)=CO2(g) ΔH="-283" kJ·mol-1
本题解析:略
本题难度:一般
3、选择题 分,每空CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 。
(3)120℃、101kPa下,a mL由CO、CH4组成的混合气体在b mLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生bmL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
②若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表达式是 。
参考答案:(1)1∶4
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=-891kJ/mol
(3)①0.33
②b≥5a/4
本题解析:略
本题难度:一般
4、选择题 常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是(?)
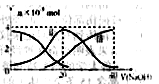
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)>?c(A2-)>c(OHˉ) ?
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大?
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)?
D.向Na2A溶液加入水的过程中,pH减小
参考答案:B
本题解析:A.当V(NaOH)="20" mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,由图可知c(A2-)>c(H2A),说明HA-电离大于水解程度,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),正确;B.由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,错误;C.根据电荷守恒得c(OH-)+2c(A2-)+c(HA-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(HA-)+c(H2A)+c(A2-),所以得c(OH-)+c(A2-)=c(H+)+c(H2A),正确;D.Na2A溶液加水稀释,促进其水解,但溶液中氢氧根离子浓度减小,所以溶液的pH减小,正确,答案选B。
本题难度:一般
5、选择题 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是(?)
A.CH3COOH
B.Al2(SO4)3
C.NaHSO4
D.Na2CO3
参考答案:B
本题解析:能水的电离程度增大的措施有:升高温度、加入能水解的盐、电解、加入活泼的金属;所以正确选项为B;
本题难度:一般