微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度1.19g/cm3.
(1)将______升氯化氢(标准状况)通入1.00L水中可以得到36.5%的浓盐酸?
(2)该浓盐酸的物质的量浓度为______.
参考答案:(1)令需要氯化氢的体积为VL,则HCl的物质的量为VL22.4L/mol=V22.4mol,故HCl的质量为V22.4mol×36.5g/mol=36.5V22.4g,1.00L水的质量为1L×1000g/L=1000g,故溶液的质量为(1000+36.5V22.4)g,故(1000+36.5V22.4)g×36.5%=36.5V22.4g,解得:V=352.8L,
故答案为:352.8;
(2)质量分数为36.5%,密度1.19g/cm3的浓盐酸的物质的量浓度为1000×1.19×36.5%36.5mol/L=11.9mol/L,
答:该浓盐酸的物质的量浓度为11.9mol/L.
本题解析:
本题难度:一般
2、选择题 阴离子 含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是?
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是?
A.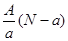 mol
mol
B.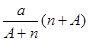 mol
mol
C.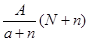 mol
mol
D.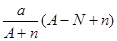 mol
mol
参考答案:D
本题解析:试题分析:电子的质量相对于质子和中子来说,可以忽略不计,a gX的氢化物(HnX)的物质的量为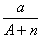 mol,HnX含有的质子数为
mol,HnX含有的质子数为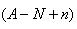 ,所以a gX的氢化物中含质子的物质的量是
,所以a gX的氢化物中含质子的物质的量是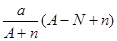 mol,答案为D。
mol,答案为D。
点评:本题考查了物质的量,原子核,是对基础知识的考查,本题有一定的难度,要理解好电子的质量相对于质子和中子来说,可以忽略不计,从而根据原子质量为质子和中子的和算出正确答案。
本题难度:简单
3、选择题 在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是(?)
A.溶质的质量分数w=(1000a/17V)100%
B.溶质的物质的量浓度c=1000a/17V (mol/L)
C.溶液中c(OH-)=b/V (mol/L)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w
参考答案:B
本题解析:A、溶质的质量分数w=(a/ρV)×100%,错误;B、正确;C、溶液中c(OH-)=b×103/V (mol/L),错误;D、上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w ,错误。
本题难度:简单
4、选择题 在2lA12(SO4)3和(NH4)2SO4的混合溶液中加2molBaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到1molNH3,则原溶液中Al3+的浓度为( )
A.2mol·L—1
B.0.25mol·L—1
C.1mol·L—1
D.0.5mol·L—1
参考答案:D
本题解析:钡离子的物质的量为2mol,正好沉淀,说明硫酸根离子也是2mol,最后得到1mol的氨气,说明有铵根离子为1mol,与铵根离子结合的硫酸根为0.5mol,则与硫酸铝结合的硫酸根为1.5mol,则铝离子的物质的量为1.5/3*2=1mol,浓度为0.5mol·L—1
点评:本题关键在于利用元素守恒的计算来解题
本题难度:简单
5、选择题 设NA表示阿伏加德罗常数的值,下列有关NA的叙述中不正确的有
A.标准状况下,20 g重水(D2O)中含有的电子数为10NA
B.乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
C.22.4 L的N2的共用电子对数为3NA
D.78gNa2O2固体中含有的阴离子数为NA