| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题预测(2017年最新版)(二)
参考答案: 本题解析: 本题难度:困难 2、选择题 根据下列物质的化学性质,判断其应用错误的是 ( ) |
参考答案:D
本题解析:A、酒精可使蛋白质变性,所以可用于杀菌消毒,正确;B、氧化钙属于碱性氧化物,二氧化硫是酸性氧化物,二者反应生成亚硫酸钙,所以氧化钙用作工业废气的脱硫剂,正确;C、明矾中的铝离子水解生成氢氧化铝胶体,具有吸附作用,用作净水剂,正确;D、用铝热反应制取单质铁,不合理,该反应需要大量的难制取的铝,消耗大量的能量,错误,答案选D。
考点:考查物质的化学性质
本题难度:一般
3、简答题 某二元酸H2A电离方程式是:H2A=H++HA-,HA-?A2-+H+.回答下列问题:
(1)Na2A溶液显______性,理由是(用离子方程式表示)______.
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能______0.11mol/L(填“<”、“>”或“=”)理由是______.
(3)某温度下,向10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是______(填写字母).
A.溶液pH=7 B.水的离子积KW=c2(OH-)
C.V=10D.c(K+)<c(Na+)
(4)0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______.
参考答案:(1)根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是:H2O+A2-?HA-+OH-,故答案为:碱性;H2O+A2-?HA-+OH-;
(2)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离生成的H+抑制了HA-的电离;
(3)A.由于温度不知道,故中性时溶液pH不能确定,故A错误;
B.中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),故B正确;
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10,故C错误
D.根据C选项判断,NaHA过量,所以c(K+)<c(Na+),故D正确.
故答案为:BD.
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
本题解析:
本题难度:一般
4、填空题 (16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下:
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
参考答案:(16分,每空2分)
I.(1)硫酸 (或者H2SO4)
(2)a d
(3)①在常压下,此反应的转化率已经达到96%,没有必要再增大压强了。
②-396.00 kJ/mo1
Ⅱ.(1)① 4.00×10-4
②
(2)① < ② 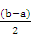
本题解析:I.(1)二氧化硫的催化氧化是工业生产硫酸的重要步骤;
(2)a、每生成1mol SO3的同时生成0.5mol O2,代表正逆两个反应方向且符合化学方程式中的系数比,符合正逆反应速率相等,达到平衡状态,正确;b、恒容条件下,气体的质量不变,所以气体的密度一直不变,不能判断是否达平衡状态,错误;c、体系中各物质的物质的量之比等于化学计量数之比时不一定达平衡状态,错误;d、该反应的特点是反应前后的气体的物质的量发生改变,所以恒容时气体的压强在变,达平衡时,气体压强不再变化,正确,答案选ac。
(3)①常压下,平衡时二氧化硫的转化率是96%,已经很高,所以没有必要再增大压强了;
②二氧化硫转化96%放出190.08KJ的热量,所以1mol二氧化硫气体完全反应则放出190.08kJ÷96%=198.00kJ的热量,所以该反应的热化学方程式中二氧化硫的系数是2,代表2mol的二氧化硫完全反应,放出的热量是198.00kJ×2=396.00kJ,所以△H=-396.00 kJ/mo1;
II.(1)①根据题意可知氨水的浓度是1mol/L, c(NH4+)= c(OH-)=0.02mol/L,所以氨水的电离常数K= c(NH4+)· c(OH-)/c(NH3·H2O)= 0.022mol/L/1mol/L= 4.00×10-4
②氨水稀释会促进一水合氨的电离,体积变为原来的2倍,则氢氧根离子浓度减小为原来的一半,根据勒夏特列原理,最终氢氧根离子、铵根离子的浓度仍会减小,所以图像的起点在0.01处,最大值在原图像的下方,如图 ;
;
(2)①若a=b,则二者恰好完全反应,溶液呈酸性,现在溶液呈中性,说明氨水过量,所以a<b;
②设二者的体积均是1L,因为b>a,则剩余氨水的物质的量是b-a,体积扩大到原来的2倍,所以剩余氨水浓度:c(NH3·H2O)=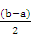 。
。
考点:考查化学平衡状态的判断,转化率的计算,热效应的计算,弱电解质的电离平衡的应用
本题难度:一般
5、选择题 表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是( )
A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)
D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-)
参考答案:B
本题解析:略
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学必考知识点《化学反应与.. | ||