| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题预测(2017年最新版)(八)
参考答案:B 本题解析:A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,当二者物质的量浓度相等时,电离产生的c(H+)盐酸大,酸电离产生的c(H+)越大,对水电离平衡的影响也就越大,在水的溶液中,水电离出的c(H+)就越小,所以水电离出的c(H+):HCl<CH3COOH,错误;B.Na2CO3和NaHCO3都是强碱弱酸盐,水解是溶液显碱性,由于等浓度时水解程度:Na2CO3>NaHCO3,所以当溶液pH相同的溶液中:c(Na2CO3)<c(NaHCO3),正确; C.在Na2SO3溶液中,根据物料守恒可得:c(Na+) = 2c(SO32— ) + 2c(HSO3— ) + 2c(H2SO3) ,错误;D.在0.1mol·L—1NaHS溶液中,根据物料守恒可得:c(Na+) = c(HS-)+ c(S2-)+ c(H2S),错误。 本题难度:一般 3、选择题 下列离子既能电离又能水解,且能与强碱溶液反应的是( ) |
参考答案:C
本题解析:CH3COO-与CO32-不能再电离,A、D不选;H2SO4是强酸HSO4-不能水解,B不选;答案选C。
本题难度:一般
4、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比 ( )
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:
正确答案:B
NaF是强碱弱酸盐,F++H2O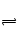 HF+OH
HF+OH
本题难度:一般
5、选择题 物质的量浓度相同,体积相同的下列各组物质的溶液混合后,pH大于7的是
A.NaHCO3、HCl、NaCl
B.K2CO3、H2SO4、HNO3
C.Na2CO3、CH3COOH、HCl
D.Na2S、HCl、H2SO4
参考答案:C
本题解析:首先考虑相互之间的反应,再考虑水解和电离.
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学必考知识点《化学反应与.. | ||