微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 50 mL18 mol·L-1硫酸溶液中,加入足量的铜片并加热,被还原的硫酸的物质的量 (? )
A.等于0.90 mol
B.等于0.45 mol
C.小于0.45 mol
D.大于0.45 mol、小于0.90 mol
参考答案:C
本题解析:n(H2SO4)=" 50" mL×18 mol·L-1="0.90" mol
Cu+2H2SO4(浓)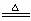 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
分析方程式,得:每2 mol浓H2SO4中,只有1 mol被还原;
且铜片足量,当浓H2SO4变为稀H2SO4时,不再与铜片反应,
所以:被还原的硫酸的物质的量小于0.45 mol
本题难度:一般
2、填空题 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
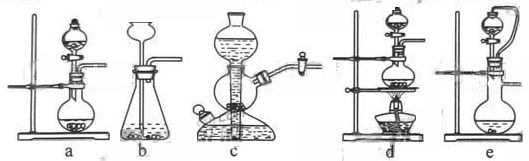
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是?(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠?g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠?g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
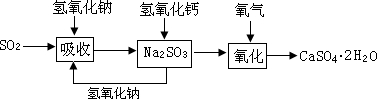
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
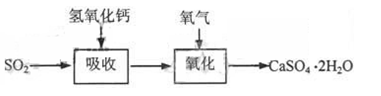
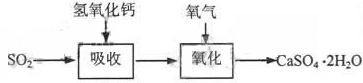
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂
| Ca(OH)2
| NaOH
|
价格(元/kg)
| 0.36
| 2.9
|
吸收SO2的成本(元/mol)
| 0.027
| 0.232
|
?
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是?。和碱法相比,石灰-石膏法的优点是?,缺点是?。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
参考答案:
本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)? H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g? 22.4L
m? 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案
本题难度:一般
3、选择题
A.二氧化硫
B.氮氧化物
C.二氧化碳
D.悬浮颗粒
参考答案:C
本题解析:城市空气质量日报的内容是二氧化硫、氮氧化物和悬浮颗粒,而二氧化碳不属于此报道内容。
本题难度:简单
4、填空题 氮是蛋白质的重要组成成分,动、植物生长都需要吸收含氮的养料。空气中虽然含有大量的氮气,但多数生物不能直接吸收氮气,只能吸收含氮的化合物。在自然界,大豆、蚕豆等豆科植物的根部都有根瘤菌,能把空气中的氮气变成含氮化合物,所以,种植这些植物时不需施用或只需施用少量氮肥。这种将游离态氮转变为化和态氮的方法,叫做氮的固定。
(1)为防治酸雨,降低燃烧时向大气排放的SO2,工业上经常将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:_______________________________________、_____________________________________。
(2)用碳酸钙代替生石灰,能否达到类似的效果? ___________。
参考答案:(1)SO2 + CaO ="=" CaSO3、2CaSO3 + O2 ="=" 2CaSO4
本题解析:(1)由前面的一段信息,读出所谓“固硫”就是将游离态的硫转变为化合态的硫,而在这过程中,为了防止污染空气,不能让硫以二氧化硫的形式产生,最好的方式是让它转化为某种固体。含硫煤燃烧时硫转化为硫的氧化物,硫的氧化物为酸性氧化物,而CaO为碱性氧化物,二者反应生成CaSO3。再考虑亚硫酸盐的还原性,可知CaSO3又会被O2氧化为CaSO4。
(2)可以用碳酸钙代替生石灰,因为碳酸钙受热分解能生成CaO。
本题难度:简单
5、选择题 诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,这是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
参考答案:D
本题解析:由题给信息,CO、NOx等在铂表面发生化学反应转变为无毒气体,由原子守恒,判断出无毒气体为CO2和N2,铂在反应中起到催化剂作用。NO、CO能与人体血红蛋白结合,而CO2不能。
本题难度:简单