微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度?②量取50mL 0.55mol/L NaOH溶液,测量温度;?③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因?。
(2)加入NaOH溶液的正确操作是? (填字母)。
A.沿玻璃棒缓慢加入? B.一次迅速加入? C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是?。
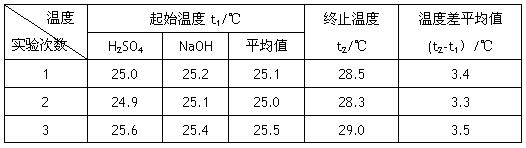
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c="4.18" J·(g·℃)-1,请根据实验数据求出中和热为 ? 写出该反应的热化学方程式_________?
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量?(填“小于”、“等于”或“大于”)57.3 kJ,原因是 ? ?
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是??(用字母表示)。
(2)观察滴定管液面的高度时应注意?
?
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是??。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是??
(5)该烧碱样品纯度的计算式为_________________________。
参考答案:Ⅰ、(1)确保硫酸被完全中和 (2)B? (3)用环形玻璃棒轻轻搅动
(4)56.85 kJ·mol-1 ?, H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O?ΔH=-113.7kJ·mol-1
(5)大于?浓硫酸溶于水放出热量
Ⅱ.答案:(1)CABDE
(2)滴定管要直立,装液后需等1~2 min后才能观察液面高度;读数时视线与液体的凹液面及刻度线在同一水平面上,读数应准确至0.01 mL
(3)使滴定终点颜色变化更明显,便于分辨? (4)偏高
因碱液样品沾在锥形瓶内壁使烧碱的物质的量增加,耗用标准酸的体积偏大,故烧碱浓度偏高
(5)0.8(V2-V1)M/W×100%
本题解析:略
本题难度:简单
2、选择题 一种化学冰袋含有Na2SO4?10H2O和NH4NO3,用时将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测中肯定错误的是( )
A.Na2SO4?10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4?10H2O脱水过程较慢
C.Na2SO4?10H2O在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
参考答案:A、Na2SO4?10H2O脱水是吸热过程,故A正确;
B、因为十水硫酸钠脱水较慢,它一点点地脱水,水遇上硝酸铵吸热,因此制冷效果可以维持较长,故B正确;
C、Na2SO4?10H2O和NH4NO3不能发生复分解反应,故C错误;
D、硝酸铵夺取硫酸钠结晶水,是一个吸热反应,同时溶解吸热,故D正确;
故选C.
本题解析:
本题难度:简单
3、选择题 铁锈的主要成分为Fe2O3· xH2O,已知298K时,由单质生成Fe2O3的ΔH=-824 kJ/mol且ΔH-T?S=-742.4 kJ/mol。计算说明在-150℃的空气中铁是否发生锈蚀?
参考答案:S=-273.8J/(mol·K),在-150℃时ΔH-T?S=-790.32kJ/mol,故能自发进行。
本题解析:根据自由能公式,S=ΔH-(-742.4 kJ/mol)/T=(-824+742.4)×1000/298=-273.8 J/(mol·K),则在-150℃时ΔG=ΔH-T?S=-824 kJ/mol-(-150+273)×(-273.8)×10-3 kJ/(mol·K)=" -790.32" kJ/mol<0,所以反应能自发进行。
本题难度:一般
4、选择题 含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) + O2(g) = NO2-(aq) + 2H+(aq) + H2O(l)?ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l)?ΔH = -273kL/mol
② NO2-(aq) + O2(g) = NO3-(aq)?ΔH = -73kL/mol
O2(g) = NO3-(aq)?ΔH = -73kL/mol
下列叙述不正确的是
A.升高温度,可使①②反应速率均加快
B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol
D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
参考答案:D
本题解析:A.任何化学反应,升高温度,反应速率均加快,正确。B.HNO2若为强酸,则在室温下时0.1 mol/L HNO2(aq) pH=1,而现在pH>1则说明HNO2是弱酸,NaNO2是强碱弱酸盐,水解使溶液显碱性,正确。C. ①+②足量可得NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l)?ΔH = -346kJ/mol,正确。D.1 mol NH4+在①反应中失去电子6mol; 1 mol NO2-在②反应中失电子数2mol。因此失去电子的物质的量的比为3:1,错误。
本题难度:一般
5、填空题 已知H+(aq)+OH-(aq)=H2O(l)? ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出________kJ热量。
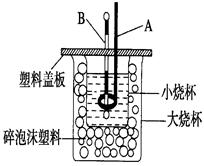
(2)如图装置中仪器A的名称是?,碎泡沫塑料的作用是?。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能是?
?。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会?(填“偏大”、“偏小”、“无影响”)。
参考答案:(1)11.46
(2)环形玻璃搅拌棒;隔热,减少热量散失
(3)实验过程中难免有热量散失(合理答案均可)
(4)偏小
本题解析:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ·mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,答案为:11.46;
(2)仪器A的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:环形玻璃搅拌棒;隔热,减少热量散失,答案为:环形玻璃搅拌棒;隔热,减少热量散失;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ·mol-1,答案为:实验过程中难免有热量散失;(合理答案均可)
(4)醋酸为弱酸,电离过程为吸热过程,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小;
本题难度:简单