|
高考化学知识点归纳《电解池原理》试题特训(2017年最新版)(十)
2017-03-05 13:59:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源?极,电极反应为?;通电一段时间后,溶液中铜离子浓度将?(增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为?;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为?(填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
下列说法中正确的是?
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以
| 恢复到电解前的物质的浓度
参考答案:(1)正? Cu-2e-=Cu2+;?阴? Cu2++2e-=Cu
(2)2NaCl+2H2O?2NaOH+H2↑+Cl2↑;BaCl2,Na2CO3,NaOH,HCl(Na2CO3必须放在BaCl2后,盐酸须放在最后,其他顺序可变)
(3)ABC
本题解析:(1)粗铜精炼时,铜失电子,作阳极,故粗铜与电源的正极相连。由于阴极只有铜
离子析出,而阳极除了铜失电子,还有锌失电子,故溶液中铜离子浓度将少。
(2)除杂的原则是除去原有杂质,并且不引入新杂质。要除去氯化钠中含有的Ca2+、Mg2+、
Fe3+、SO42-等,除去Mg2+、Fe3+可以加入氢氧化钠,二者均生成沉淀,除去SO42-加入
过量的氯化钡,不能加入Ba(NO3)2,否则会引入硝酸根离子,加入稍过量碳酸钠,除
Ca2+和少过量的Ba2+,最后加入盐酸除去过量的碳酸根离子和氢氧根离子。
(3)由Na+移动方向判断E为阴极,产生NaOH和H2,A正确;据电解总反应式可知2NaOH—Cl2,计算C正确;D项中,应通入HCl气体,若加入盐酸会增加水的量,故D项错。
本题难度:一般
2、填空题 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。 2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。 2NO(g)的△H__________0(填“>”或“<”)。

②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
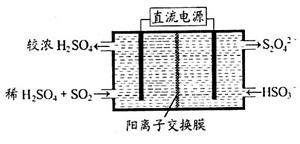
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃 料电池,可用作电解池的电源。其工作原理如图所示
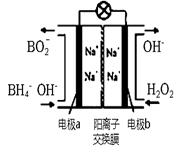
①写出a极上的电极反应式: ,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
参考答案:(1)① > (1分) ②0.01mol·L-1·s-1 (1分)(其它每空2分) 14.3%
(2)①SO2 + 2H2O
本题解析:
本题难度:困难
3、选择题 用惰性材料作电极,分别电解下列物质,当相同电量时,下列指定的电极上析出气体质量最大的是
A.熔融的NaCl(阳极)
B.NaCl溶液(阴极)
C.NaOH溶液(阴极)
D.Na2SO4(阳极)
参考答案:A
本题解析:电解熔融氯化钠、氯化钠溶液、氢氧化钠溶液和硫酸钠溶液的方程式分别为:2NaClO 2Na+Cl2↑~2e-、2NaCl+2H2O 2Na+Cl2↑~2e-、2NaCl+2H2O 2NaOH+Cl2↑+H2↑~2e-、2H2O 2NaOH+Cl2↑+H2↑~2e-、2H2O 2H2↑+O2↑~4e-、2H2O 2H2↑+O2↑~4e-、2H2O 2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。 2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。
本题难度:一般
4、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是
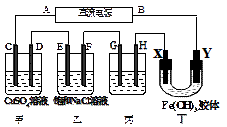
A.电源B是负极
B.甲乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1︰2︰2︰2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液选择AgNO3溶液
D.装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷
参考答案:C
本题解析:略
本题难度:简单
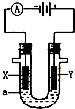
5、选择题 如图所示,X.Y都是石墨电极,a是饱和食盐水,实验开始时,同时在U型管的两边各滴入几滴酚酞试液,下列叙述正确的是?( )
A.Y是阳极,该电极附近有无色气体产生
B.电解时电能将转变为化学能
C.X是负极,该电极附近先观察到溶液变红色
D.电解一段时间收集产生的气体,Y电极得到气体体积稍大
|