| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《水的电离平衡》在线测试(2017年最新版)(六)
参考答案:D 本题解析:混合后溶液显碱性,说明氢氧化钠是过量的,即0.001L×0.1mol/L<0.01L×10(b-14),解得b>12,所以只有选项D是正确的。 本题难度:简单 3、计算题 (共12分) 参考答案: 本题解析: 本题难度:一般 4、选择题 室温时,将xmLpH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( ) |
参考答案:D
本题解析:由题可知,n(NaOH)=x×10-3×10a-14mol,n(HCl)= y×10-3×10-bmol。
故 ,分步讨论:
,分步讨论:
(1)若x=y,,则n(NaOH)=n(HCl),二者恰好反应,pH=7
(2)若10x=y,且a+b=13,则n(HCl)=100n(NaOH),HCl过量,pH<7
(3)若ax=by,且a+b=13,则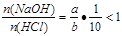 (因a>7,b<7),HCl过量,
(因a>7,b<7),HCl过量,
(4)若x=10y,且a+b=14,则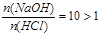 ,NaOH过量,pH>7
,NaOH过量,pH>7
所以答案选D。
考点:混合溶液pH的计算
点评:混合溶液pH的计算要注意过量问题。
本题难度:一般
5、选择题 下列叙述正确的是
A.把纯水加热,水的电离程度增大,但水仍然是中性的,pH=7
B.在醋酸溶液中加入少量的CH3COONa(s),测得pH变大,主要原因是CH3COONa水解呈碱性,中和醋酸电离的H+
C.pH=3的醋酸溶液,稀释至10倍后pH<4
D.相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
参考答案:C
本题解析:水的电离是吸热过程,升高温度,促进水的电离,但c(OH-)=c(H+),水仍然呈中性,但pH减小,A错误;CH3COOH CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。
CH3COO-+H+,向醋酸溶液中加入醋酸钠固体,c(CH3COO-)增大,平衡向左移动,c(H+)减小,pH增大,B错误;pH=3的醋酸中c(H+)=10-3mol/L,稀释至10倍后,CH3COOH继续电离补充H+,所以c(H+)>10-4mol/L,pH<4,C正确;酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:Na2CO3>CH3COONa,D错误。
考点:水的电离 弱电解质的电离平衡 溶液的稀释与pH 盐类的水解
点评:pH相同的弱酸与强酸稀释相同的倍数后,强酸pH变化大,因稀释过程中弱酸继续电离补充H+。同理,pH相同的强碱与弱碱稀释相同的倍数后,强碱pH变化大。
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点归纳《物质的量》.. | ||