微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种金属粉末的混合物26g,溶于足量的稀H2SO4中,生成标准状况下的氢气11.2L,则这种混合物可能是( )
A.Na和Mg
B.Na和Al
C.Mg和Al
D.Al和Fe
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列有关化学用语的表示,正确的是
A.质子数为92,中子数为146的U原子: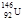
B.CCl4分子的比例模型:
C.甲醛与醋酸的最简式相同
D.2-甲基丁醇的结构简式: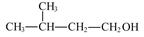
参考答案:C
本题解析:A、质子数为92,中子数为146的U原子质量数为238,错误;B、CCl4分子中氯原子半径大于碳原子半径,与比例模型不符,错误;C.甲醛与醋酸的最简式均为CH2O,相同?,正确;D、?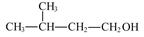 的名称:3-甲基-1-丁醇,错误。
的名称:3-甲基-1-丁醇,错误。
本题难度:一般
3、简答题 (16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
方法1
| 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为:
2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1
2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1
|
方法2
| 用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸
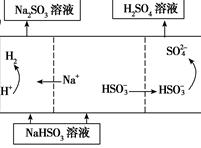
|
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
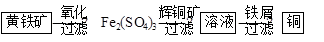
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
参考答案:(共16分)
(1)①能大大降低能源消耗;利于减少污染(写一条且正确得2分)
(2)Cu2O、Cu2S(2分,写名称也可得2分,写一个得1分)
(3)S(g)+O2(g)=SO2(g) ΔH=-574.0kJ·mol-1(3分,没有写聚集状态扣1分,没有写负号1分,没有数字和单位扣1分)
(4)HSO3-+H2O-2e-===SO42-+3H+ (左边出现HSO3-得1分,共3分)
(左边出现HSO3-得1分,共3分)
(5)4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4(没有写条件扣1分,没有配平扣1分,共3分)
2Fe2(SO4)3+2H2SO4(没有写条件扣1分,没有配平扣1分,共3分)
(6)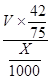 mol/L或
mol/L或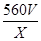 mol/L(3分,有
mol/L(3分,有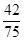 可以得1分)
可以得1分)
本题解析:(1)①方法二消耗了电能,方法一没有消耗电能,所以能大大降低能源消耗;利于减少污染。
(2)2Cu2O+Cu2S=6Cu+SO2↑反应中铜元素的化合价从+1降低到0,所以氧化亚铜和硫化亚铜都做氧化剂。
(3)反应①:2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0kJ·mol-1,和CO的燃烧热283.0kJ·mol-1,则反应②:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,根据盖斯定律,②×2-①,反应热为-283×2-8=574kJ·mol-1,所以热化学方程式为:S(g)+O2(g)=SO2(g) ΔH=-574.0kJ·mol-1。(4)阳极失去电子化合价升高,从图分析亚硫酸氢根失去电子产生硫酸根离子,电极反应为:HSO3-+H2O-2e-===SO42-+3H+。(5)黄铁矿被氧化成硫酸铁,方程式为:4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4。
2Fe2(SO4)3+2H2SO4。
(6)Cu2S+10Fe3++4H2O=2Cu2++10Fe2++8H++SO42-,Cu2++Fe=Fe2++Cu,2H++Fe=Fe2++H2,根据硫原子守恒,硫元素最后都到硫酸亚铁,所以有关系:15O2----8.4FeSO4,亚铁离子物质的量为8.4V/15,亚铁离子浓度为: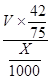 mol/L或560
mol/L或560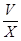 mol/L。
mol/L。
考点:氧化还原反应,盖斯定律,电解原理的应用,原子守恒法计算。
本题难度:困难
4、选择题 下列有关化学用语使用正确的是
A.CO2的电子式: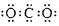
B.中子数为20的氯原子: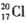
C.正丁烷的结构简式: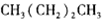
D.铝离子结构示意图: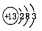
参考答案:C
本题解析:A项:C和O之间共用的是两对电子,故错;B项:原子的左上角是质量数,故错;D项:铝离子的是铝原子失去最外层电子形成的,故错。故选C。
点评:考查常用化学用语,难度不大,注意掌握常用化学用语的书写。
本题难度:一般
5、选择题 下列化学用语表达正确的是
A.一氯乙烷的结构式为CH3Cl
B.丁烷的结构简式为CH3(CH2)2CH3
C.四氯化碳的电子式为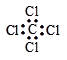
D.苯的分子式为
参考答案:B
本题解析:A不正确,一氯甲烷的结构式是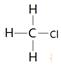 ;B正确,C不正确,四氯化碳的电子式是
;B正确,C不正确,四氯化碳的电子式是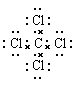 ;苯的分子式是C6H6,D不正确,答案选B。
;苯的分子式是C6H6,D不正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:简单