| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《有关氧化还原反应的计算》高频考点特训(2017年练习版)(八)
参考答案:D 本题解析:氮、氧物质的量比为7/14:20/16=2:5,所以氮的氧化物化学式为N2O5,氮为+5价。 本题难度:一般 2、填空题 氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列所提供的反应中电子转移发生在相同价态的同种元素之间的有?(填序号,下同);电子转移发生在不同价态的同种元素之间的有?;电子转移发生在不同元素之间的有?。? 参考答案: 本题解析:略 本题难度:一般 3、选择题 下列有关化学用语表示正确的是 参考答案:A 本题解析::质子数为53、中子数为78,则质量数为131,A正确;N2的电子式漏写了两对孤对电子,应为 本题难度:一般 4、选择题 0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是 |
参考答案:D
本题解析:
试题解析:A、金属离子全部沉淀时,得到0.78g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为0.78g-0.44g=0.34g,氢氧根的物质的量为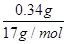 =0.02mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
=0.02mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则: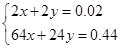 ,解得x=0.005,y=0.005,故合金中铜与镁的物质的量之比是0.005mol:0.005mol=1:1,故A错误;B、该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为
,解得x=0.005,y=0.005,故合金中铜与镁的物质的量之比是0.005mol:0.005mol=1:1,故A错误;B、该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为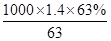 mol/L=14mol/L,故B错误;C、NO2和N2O4混合气体的物质的量为
mol/L=14mol/L,故B错误;C、NO2和N2O4混合气体的物质的量为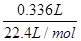 =0.015mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.015-a)mol,根据电子转移守恒可知,a×1+(0.015-a)×2×1=0.02,解得a=0.01,故NO2的体积分数是
=0.015mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.015-a)mol,根据电子转移守恒可知,a×1+(0.015-a)×2×1=0.02,解得a=0.01,故NO2的体积分数是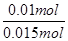 ×100%=66.7%,故C错误;D、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.1L×14mol/L-0.01mol-(0.015-0.01)×2=1.38mol,故需要氢氧化钠溶液的体积为
×100%=66.7%,故C错误;D、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.1L×14mol/L-0.01mol-(0.015-0.01)×2=1.38mol,故需要氢氧化钠溶液的体积为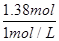 =1.38L=1380mL,故D正确。
=1.38L=1380mL,故D正确。
考点:化学计算
本题难度:一般
5、填空题 在氧化还原反应中,氧化过程和还原过程是同时发生的。
Cu2O—2e-+2H+=2Cu2++H2O是一个氧化过程的反应式,下列五种物质FeSO4、Fe2(SO4)2、CuSO4、Na2CO3、KI中的一种能使上述氧化过程顺利发生。
(1)写出并配平该反应的离子方程式: ;
反应中氧化剂和还原剂的物质的量之比是 。
(2)向(1)中反应后的溶液里,加入酸性高锰酸钾溶液,反应的离子方程式为
;CH2+、MnO4、Fe3+的氧化性由强到弱的顺序是 (用离子符号表示)。
参考答案: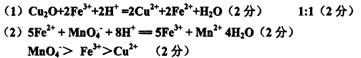
本题解析:略
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点整理《水的电离平.. | ||