微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制100mL 1mol/LNaOH溶液,下列操作中正确的是
A.在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.用蒸馏水洗涤烧杯、玻璃棒2---3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
参考答案:C
本题解析:
解决本题学生应有较好的实验技能。
A:中称量NaOH应放在烧杯中。
B:超过容量瓶刻度线后实验失败,应重做。
C:正确,洗涤可以防止溶质的非正常损失。
D:加蒸馏水时应在离刻度线1-2厘米时改用胶头滴管;加水到水平观察凹面最低处刚好与刻度线相切。
本题难度:一般
2、选择题 将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
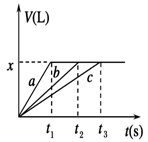
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
参考答案:C
本题解析:钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属再与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L,即选项A、B、D正确,C不正确,所以答案选C。
本题难度:一般
3、实验题 (1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________。
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________ mL量筒最好。
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的烧杯里,并不断搅拌,目的是_______ 。
④加水至液面接近刻度线1-2cm时,改用________加水,使溶液的凹液面正好跟刻度线相平。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①定容时观察液面俯视:________;②NaOH颗粒表面部分变质:________。
(3)Fe(OH)3胶体的制备方法为:
参考答案:(1)①13.6mL②15③使硫酸与水混合均匀且使热量迅速散失;④胶头滴管
(2)①偏高 ②偏低
(3)向沸水中滴加饱和氯化铁溶液,继续加热煮沸,至溶液变为红褐色时停止加热。
本题解析:(1)①98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是1000×1.84×98%/98=18.4mol/L,0.5 mol/L的稀H2SO4 500 mL中的硫酸的物质的量是0.5L×0.5mol/L=0.25mol,设需要浓硫酸的体积是VL,则18.4V=0.25mol,解得V=0.0136L,即13.6mL;
②选中的量筒的量程越接近量取的溶液的体积,误差越小,所以选择15mLd的量筒;
③浓硫酸的稀释过程中放出大量的热,搅拌的目的是使硫酸与水混合均匀且使热量迅速散失;
④配制溶液时,在快接近刻度线时改用胶头滴管滴加水至刻度线;
(2)①定容时俯视刻度线,则所读数据偏上,即溶液的体积偏小,溶液不等偏高;②氢氧化钠部分变为碳酸钠,则所配溶液的浓度偏低;
(3)实验室配制氢氧化铁胶体的方法是:向沸水中滴加饱和氯化铁溶液,继续加热煮沸,至溶液变为红褐色时停止加热。
考点:考查我带走了浓度与质量分数的换算,溶液配制实验中误差分析,氢氧化铁胶体的制备
本题难度:一般
4、选择题 把0.05mol醋酸分别加入到下列100mL溶液中,溶液的导电能力变化最明显的( )
A.0.5mol/LNaOH溶液
B.0.5mol/L盐酸
C.0.5mol/LNH4Cl溶液
D.0.5mol/L氨水
参考答案:A、100mL0.5mol/LNaOH溶液中加入0.05mol醋酸,得到100mL0.5mol/LNaAc溶液,离子浓度变化基本不变,则溶液的导电性不变,故A不选;
B、100mL0.5mol/L的盐酸溶液中加入0.05mol醋酸,得到100mL0.5mol/LHCl和0.5mol/L的醋酸溶液,但盐酸电离生成的氢离子抑制醋酸电离,离子的浓度比原来的大些,导电性比原来的强,故B不选;
C、100mL0.5mol/LNH4Cl溶液中加入0.05mol醋酸,得到100mL0.5mol/LNH4Cl和0.5mol/L的醋酸溶液,但NH4Cl电离生成的铵根离子抑制醋酸电离,离子的浓度比原来的大些,导电性比原来的强,故C不选;
D、因0.5mol/L氨水中存在电离平衡,电离的程度很弱,溶液中的离子浓度很小,导电性差,但0.05mol醋酸加入到100mL0.5mol/L氨水溶液中得到100mL0.5mol/LNH4Ac溶液,NH4Ac是强电解质,在水中完全电离,则离子浓度增大明显,导电性变化明显,故D选;
故选D.
本题解析:
本题难度:一般
5、选择题 将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入足量的4mol·L-1的NaOH溶液,使金属离子完全沉淀。则形成沉淀的质量是(?)
A.43.2g
B.46.8g
C.53.6g
D.63.8g
参考答案:B
本题解析:最终的沉淀是氢氧化铜和氢氧化镁的混合物,其质量就是金属的质量和金属阳离子结合的OH-的质量。由于金属失去的电子的物质的量就是结合的OH-的物质的量,而金属失去的电子是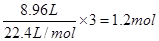 ,所以结合的OH-的物质的量就是1.2mol,质量是20.4g,所以最终沉淀的质量是46.8g,答案选B。
,所以结合的OH-的物质的量就是1.2mol,质量是20.4g,所以最终沉淀的质量是46.8g,答案选B。
本题难度:简单