微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向甲烧杯中加入盐酸,乙烧杯中加入醋酸,两种溶液的体积和pH 都相等。再向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法中正确的是
[? ]
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
参考答案:C
本题解析:
本题难度:一般
2、选择题 有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中H+物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
参考答案:C
本题解析:醋酸时弱酸,存在电离平衡,醋酸浓度越小,电离程度越大。所以c(甲)>10c(乙),A不正确,C正确。B不正确,应该是10倍。D不正确,应该是0.1倍,答案选C。
本题难度:一般
3、实验题 某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃)
| 10
| 20
| 30
| 50
| 70
| 80
| 100
|
pH
| 8.3
| 8.4
| 8.5
| 8.9
| 9.4
| 9.6
| 10.1
|
?
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
参考答案:(本题共12分,每空1分)
(1)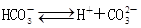 、
、 水解平衡,溶液显碱性
水解平衡,溶液显碱性
(2)加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应或促进水解平衡,产生二氧化碳。
(3)水分蒸发,NaHCO3发生分解反应,NaHCO3水解平衡被促进
(4)相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3
(5)排除因水分蒸发导致pH增大的因素。NaHCO3常温下即可发生分解反应或碳酸氢钠水解平衡和二氧化碳溶解平衡移动。
(6)是NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有。(相关合理答案均可得分)
本题解析:(1)NaHCO3为弱酸酸式盐,可发生电离,也发生水解反应,根据实验1表中数据可知NaHCO3溶液呈碱性,所以以水解为主。
(2)加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊,说明生成的气体为CO2。
(3)实验2温度升高,溶液的pH增大,说明加热促进了NaHCO3的水解,实验三生成了CO2,可能为NaHCO3发生了分解反应。
(4)Na2CO3溶液的pH大,说明Na2CO3溶液的碱性强,水解程度大。
(5)加水至200mL,与原溶液体积相同,排除因水分蒸发而导致pH增大;常温下溶液的pH增大,可能是NaHCO3在常温下分解,也可能是NaHCO3的水解程度增大,或CO2的溶解平衡移动造成的后果。
(6)NaHCO3溶液加热后pH增大,可能为NaHCO3发生分解生成碳酸钠,也可能是NaHCO3水解平衡向右移动,或者两种都有,需要进一步研究。
本题难度:困难
4、选择题 下列关于0.1 mol·L-1氨水的叙述正确的是
A.加入少量氯化钠溶液,平衡不移动
B.加入少量NaOH固体,平衡正向移动
C.通入少量氯化氢气体,平衡正向移动
D.加入少量MgSO4固体,抑制NH3·H2O电离
参考答案:C
本题解析:A、一水合氨是弱电解质,在氨水中存在电离平衡NH3·H2O NH4++OH-,加入少量氯化钠溶液,相当于是稀释,平衡向正反应方向移动,A不正确;B、加入少量NaOH固体,增大溶液中OH-的浓度,平衡逆向移动,B不正确;C、通入少量氯化氢气体,中和溶液中的OH-,降低溶液中的OH-的浓度,因此平衡正向移动,C正确;D、加入少量MgSO4固体,Mg2+结合OH-生成氢氧化镁沉淀,降低溶液中的OH-浓度,促进NH3·H2O电离,D不正确,答案选C。
NH4++OH-,加入少量氯化钠溶液,相当于是稀释,平衡向正反应方向移动,A不正确;B、加入少量NaOH固体,增大溶液中OH-的浓度,平衡逆向移动,B不正确;C、通入少量氯化氢气体,中和溶液中的OH-,降低溶液中的OH-的浓度,因此平衡正向移动,C正确;D、加入少量MgSO4固体,Mg2+结合OH-生成氢氧化镁沉淀,降低溶液中的OH-浓度,促进NH3·H2O电离,D不正确,答案选C。
本题难度:一般
5、选择题 下列关于等物质的量浓度、等体积的盐酸和醋酸溶液说法正确的是( )
A.在相同条件下,导电能力相同
B.分别稀释到等pH时,得到稀溶液的体积相同
C.分别与足量锌反应时,相同状况下产生的V(H2)不同
D.分别与氢氧化钠溶液反应得到中性溶液时,消耗的n(NaOH)不同
参考答案:D
本题解析:
本题难度:一般