微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 写出下列物质在水溶液中的电离方程式:
HNO3______Ba(OH)2______K3PO4______NaHSO4______.
参考答案:HNO3、Ba(OH)2、K3PO4、NaHSO4均能完全电离,电离方程式分别为HNO3=H++NO3-、Ba(OH)2=Ba2++2OH-、K3PO4=3K++PO43-,
NaHSO4是具有强酸性的盐,能完全电离出三种离子,即NaHSO4=Na++H++SO42-,
故答案为:HNO3=H++NO3-;Ba(OH)2=Ba2++2OH-;Na3PO4=3Na++PO43-;NaHSO4=Na++H++SO42-.
本题解析:
本题难度:一般
2、填空题 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号
| 待测NaOH溶液体积/mL
| HCl溶液体积/mL
|
1
| 25.00
| 24.41
|
2
| 25.00
| 24.39
|
3
| 25.00
| 24.60
|
回答下列问题:
(1)图中甲为 滴定管(填“酸式”或“碱式”)

(2)①配制标准盐酸时,不需要用到的仪器是________;
A.托盘天平
B.容量瓶
C.酸式滴定管
D.量筒
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,眼睛要___________________。
(3)取待测液NaOH溶液25.00mL 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是_________
(4)若酸式滴定管不用标准盐酸润洗,将使所测结果 (填“偏高”“偏低”“不变”,下同);若读数时,滴定前仰视,滴定后正确读数,则所测结果 。
(5)未知浓度的NaOH溶液的物质的量浓度为 mol/L。
参考答案:(1)酸式;(2)①AC;②注视锥形瓶中溶液颜色的变化;(3)当最后一滴标准盐酸滴入时,溶液由红色变为无色,且半分钟内不恢复原色;(4)偏高 偏低;(5)0.1288。
本题解析:(1)甲滴定管的下端是玻璃活塞,名称为酸式滴定管,乙滴定管的下方是橡胶管,名称为碱式滴定管,答案为:酸式;(2)①配制标准盐酸步骤有计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作;一般用量筒量取(用到胶头滴管),在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀;所以需要的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管;配制过程不需要的仪器是托盘天平、酸式滴定管,故选AC;②滴定操作中,眼睛要注视锥形瓶中溶液颜色的变化;(3)酚酞遇碱变红,滴定终点的判断依据是:当最后一滴标准盐酸滴入时,溶液由红色变为无色,且半分钟内不恢复原色;(4)若酸式滴定管不用标准盐酸润洗,所装标准液浓度偏低,导致标准液的体积偏大,根据c(待测)= 分析, C(待测)偏高;若读数时,滴定前仰视,滴定后正确读数,导致标准液的体积偏小,根据c(待测)=
分析, C(待测)偏高;若读数时,滴定前仰视,滴定后正确读数,导致标准液的体积偏小,根据c(待测)= 分析, C(待测)偏低;(5)根据表中数据,第3次数据偏差太大,舍去,所用标准盐酸的平均体积为:
分析, C(待测)偏低;(5)根据表中数据,第3次数据偏差太大,舍去,所用标准盐酸的平均体积为: ,c(待测)=
,c(待测)= =
= =0.1288mol/L。
=0.1288mol/L。
考点:考查酸碱中和滴定及配制一定物质的量浓度的溶液的应用。
本题难度:困难
3、计算题 (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH= ;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH= 。
参考答案:(1) 1 13 (2) 8
本题解析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为 mol/L =10-8mol/L,pH=8。
mol/L =10-8mol/L,pH=8。
考点:pH计算
点评:计算碱溶液pH时利用c(H+)= 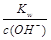 ,再求pH。
,再求pH。
本题难度:一般
4、选择题 能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7
③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②④
B.①③④
C.①③
D.②④