| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《盐类水解的原理》试题巩固(2017年最新版)(八)
参考答案:B 本题解析:NaHCO3中,溶液呈碱性,水解大于电离,故有Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);根据电荷守恒B正确。 本题难度:一般 2、填空题 有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白: (1)A是___________,B是___________,C是____________,D是___________。 (2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中 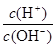 = ; = ;(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。 (4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。 参考答案:(1)Na2CO3 NH4Cl Ba(OH)2 Na2SO4 本题解析:①A、C溶液的pH均大于7,说明A、C是碱或者是强碱弱酸盐,A、B的溶液中水的电离程度比纯水大,说明A、B均含有弱根离子。A、D焰色反应的火焰均为黄色,说明A、D均含有钠元素。 本题难度:困难 3、选择题 常温下,稀释0.1 mol·L-1Na2CO3溶液,图中的纵坐标可以表示 |
参考答案:C
本题解析:碳酸钠溶于水CO32-水解CO32-+H2O HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
H2CO3+OH-。稀释促进水解。根据图像可知,随着水的加入,纵坐标是增加的。A、水解平衡常数只与温度有关系,因此稀释过程中水解平衡常数不变,A不正确;B、稀释促进水解,溶液中OH-个数增加,但OH-浓度降低,因此溶液的pH减小,B不正确;C、稀释促进水解,HCO3-的浓度减小,但HCO3-个数增加,C正确;、稀释促进水解,c(CO32-)减小,D不正确,答案选C。
考点:考查稀释对碳酸钠水解平衡的影响以及离子浓度变化判断
本题难度:一般
4、选择题 在0.1 mol·L-1的NaHS溶液中,下列关系式正确的是
A.c(Na+)=c(HS-)+2c(S2-)+c(H2S)
B.c(HS-)=c(Na+)+c(H+)-c(OH-)-c(S2-)
C.c(OH-)=c(H+)+c(H2S)+c(S2-)
D.c(H+)=c(OH-)+c(S2-)-c(H2S)
参考答案:D
本题解析:试题分析:本题考查学生对电解质溶液部分电荷守恒和物料守恒的理解和掌握。A选项,S2-前面有系数2,不是物料守恒表达式,有H2S分子,又不是电荷守恒关系式,A项错误。B选项,S2-带2个单位负电荷,前面应该乘以2,电荷守恒关系式错误。C选项,质子守恒关系式应为:c(OH-)=c(H+)+2c(H2S)+c(HS-),所以错误。D选项是电荷守恒c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)与物料守恒c(Na+)=c(HS-)+c(S2-)+c(H2S)相减的结果,正确。
考点:离子浓度大小的比较。
本题难度:困难
5、选择题 常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl?) + c(ClO?) + c(OH?)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3?) > c(CO32?) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl?) = c(NH4+) > c(OH?) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合: 2c(H+) – 2c(OH?) = c(CH3COO?) – c(CH3COOH)
参考答案:D
本题解析:氯水中加入氢氧化钠固体,溶液中电荷守恒式为c(Na+) +c(H+) = c(Cl?) + c(ClO?) + c(OH?):,A错误;pH = 8.3的NaHCO3溶液呈碱性,说明HCO3?水解强于电离,所以c(H2CO3) > c(CO32?),B错误;pH = 11的氨水与pH = 3的盐酸等体积混合溶液后氨水过量,溶液不呈中性,C错误;0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后电荷守恒:c(Na+) +c(H+)= c(CH3COO?)+ c(OH?)、物料守恒:c(CH3COO?) + c(CH3COOH)="2" c(Na+),c(CH3COOH)+2 c(H+)= c(CH3COO?)+ 2c(OH?),D正确。
考点:微粒浓度比较
点评:灵活运用电荷守恒和物料守恒,注意弱酸酸式根电离与水解以哪种为主。
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《原电池原理.. | ||