微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将标准状况下的a升氯化氢气体溶于100克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是
A、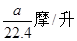 ?B、
?B、 ? C ?
? C ?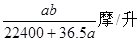 ?D、
?D、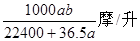
参考答案:D
本题解析:
正确答案:D
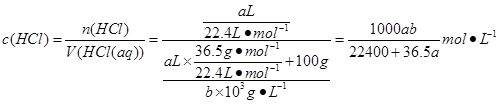
本题难度:一般
2、选择题 常温下,0.1mol/L某一元酸(HA)的pH>1,在0.1mol/L某一元碱(BOH)中H+和OH—离子物质的量浓度的关系为: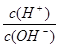 ?=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是(? )
?=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是(? )
A. C(B+)>C(A-)>C(OH-)>C(H+)
B. C(A-)>C(B+)>C(H+)>C(OH-)
C. C(B+)=C(A-) + C(HA)?
D. C(B+)+ C(H+)=C(A-)+ C(OH-)
参考答案:B
本题解析:常温下,0.1mol/L某一元酸(HA)的pH>1,所以HA是弱酸。又因为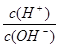 =10-12,所以根据水的离子积常数可知,溶液中OH-物质的量浓度是0.1mol/L,这说明BOH是一元强碱。二者混合后恰好反应,生成强碱弱酸盐,水解显碱性,因此A、D正确,B不正确。C符合物料守恒,正确,答案选B。
=10-12,所以根据水的离子积常数可知,溶液中OH-物质的量浓度是0.1mol/L,这说明BOH是一元强碱。二者混合后恰好反应,生成强碱弱酸盐,水解显碱性,因此A、D正确,B不正确。C符合物料守恒,正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,基础性强,侧重考查学生分析问题、解决问题的能力。该题的关键是准确判断出酸碱的强弱,然后灵活运用即可。
本题难度:简单
3、选择题 氢气燃烧的热化学方程式,可用下列两种方程式表示: 2H2(g)+O2(g)===2H2O(l)+Q1?kJ H2(g)+12O2(g)===H2O(g)+Q2?kJ Q1与Q2的关系为?
[?]
A.Q1=Q2?
B.Q2>Q1
C.Q1>2Q2?
D.Q1<2Q2
参考答案:C
本题解析:
本题难度:简单
4、选择题 在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L,则该溶液的pH可能为( )
A.12
B.7
C.6
D.2
参考答案:AD
本题解析:25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L,则溶液为抑制水的电离,即该溶液可以为酸溶液,也可以为碱性溶液;所以选项为AD。
本题难度:一般
5、选择题 下列叙述正确的是
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)后者大
D.0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:AC
本题解析:pH=5,说明溶液中氢离子的浓度就是1×10-5mol/L,所以选项A正确;稀释促进碳酸钠的水解,pH减小。但水的离子积常数只与温度有关系,是不变的,B不正确;氢氧化钡是强碱,抑制水的电离。碳酸钠水解促进水的电离,选项C正确;根据电荷守恒定律可知,选项D中应该是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),所以正确的答案选AC。
本题难度:一般