微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在反应3NO2+H2O=2HNO3+NO中,H2O( )
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂也不是还原剂
参考答案:在反应3NO2+H2O=2HNO3+NO中,化合价发生变化的只有N元素,
反应中NO2既是氧化剂又是还原剂,H和O元素的化合价没有发生变化,所以水既不是氧化剂也不是还原剂.
故选D.
本题解析:
本题难度:简单
2、简答题 已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是______,化合价没有发生变化的反应物是______.
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):______.
(3)上述反应中,1mol氧化剂在反应中______(填“得到”或“失去”)______mol电子.
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色.说出NaBiO3的一个性质:______.
参考答案:将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则反应物为HCl、KMnO4,且还原剂为
HCl,氧化剂为KMnO4;
则氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4,
(1)该反应中Cl元素的化合价升高,H、S、O元素的化合价没有变化,则化合价升高的反应物为KCl,化合价没有发生变化的反应物为H2SO4,故答案为:KCl;H2SO4;
(2)KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O,
故答案为:2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O;
(3)该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子,故答案为:得到;5;
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子,故答案为:NaBiO3具有强氧化性.
本题解析:
本题难度:一般
3、选择题 日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.铁制菜刀生锈
C.大理石雕像被酸雨腐蚀毁坏
D.铝锅表面生成致密的氧化膜
参考答案:C
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E五种短周期元素的原子序数依次增大,且已知:①其原子半径的大小关系是:D>E>B>C>A;②A、D同主族,可形成离子化合物;③B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;④B、E两元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和.请填写下列空白:
(1)常温下,浓度均为0.lmol/L的B、D的最高价氧化物对应的水化物溶液中,水电离出的c(H+)的相对大小关系为X______Y(填写“大于”“于”或“等于”),化合物BA5所属晶体类型为离子晶体,其电子式为______.
(2)在合成BA3的实际生产过程中,常采取______的方法,使气态BA3变成液态后从混合气体中分离出去,以促使化学平衡向生成BA3的方向移动.
(3)E单质与足量的D的最高价氧化物的水化物溶液反应的离子方程式为______;BC2与水反应被氧化与被还原的物质的量之比是______.
(4)已知在298K时,lg?B2A4气体燃烧生成B2和A2C气体,放出16.7kJ的热量.该燃烧反应的热化学方程式______.
(5)X、Y分别是B、C与A形成的10电子微粒,请你提供一个能验证X结合H+能力较Y强的离子方程式______.
参考答案:由题干条件可知,A、B、E是在三个不同周期的短周期主族元素,B、C在同一周期(第二周期),D、E在同一周期(第三周期),A为H元素,A、D同主族,可形成离子化合物,可形成NaH,D为Na元素,B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,则一定有Al元素,因D为Na,则E为Al,可形成含氧酸盐,则所得盐中均含C元素,C应为O元素,B为N元素,则
(1)B、D的最高价氧化物对应的水化物分别为HNO3、NaOH,都为强电解质,浓度相同时,对水的电离的抑制程度相同,则水电离出的c(H+)的相对大小关系X等于Y,化合物NH5所属晶体类型为离子晶体,应为NH4H,为离子化合物,电子式为
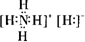
,
故答案为:等于;
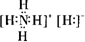
;
(2)使气态NH3变成液态后从混合气体中分离出去,应采用液化的方法,有利于平衡向正反应方向移动,
故答案为:冷却;
(3)Al与NaOH反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,在反应3NO2+H2O=2HNO3+NO中,被氧化与被还原的物质的量之比2:1,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;2:1;
(4)n(N2H4)=132mol,则1molN2H4气体燃烧放出的热量为32×16.7kJ=534.4kJ,
所以该燃烧反应的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.4kJ/mol,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.4kJ/mol;
(5)X、Y分别是B、C与A形成的10电子微粒,则X为NH3,Y为H2O,NH3可与H3O+反应生成NH4+,
发生NH3+H3O+=NH4++H2O,说明NH3结合H+能力较H2O强,故答案为:NH3+H3O+=NH4++H2O.
本题解析:
本题难度:一般
5、选择题 下列反应中,既属于氧化还原反应,又属于离子反应的是( )
A.铝片与稀盐酸的反应
B.甲烷与氧气的反应
C.灼热的炭与二氧化碳反应生成一氧化碳
D.氢氧化钠溶液与稀盐酸的反应
参考答案:A
本题解析:解析:A、铝片与稀盐酸的反应,属于在溶液中可发生的离子反应,反应的离子方程式为2Al+6H+=3H2↑+2Al3+,元素的化合价发生变化,属于氧化还原反应,故A符合;
B、甲烷与氧气的反应不是离子反应,化合价发生变化,属于氧化还原反应,故B不符合;
C、灼热的炭与二氧化碳反应生成一氧化碳不是离子反应,化合价发生变化,属于氧化还原反应,故C不符合;
D、氢氧化钠溶液与稀盐酸的反应,属于在溶液中可发生的离子反应,反应的离子方程式为OH-+H+=H2O,各元素的化合价都没有发生变化,不属于氧化还原反应,故D不符合;
所以答案选A
本题难度:简单