微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
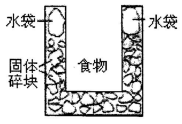
A.硝酸铵
B.生石灰
C.氯化镁
D.石灰石
参考答案:B
本题解析:水与固体碎块混和,杯内食物温度逐渐上升,这说明和水的混合过程是放热的。则选项B正确,A中是吸热的,C中热量不明显,D中不溶于水,答案选B。
点评:该题是基础性试题的考查,试题贴近生活实际,有利于调到学生的学习兴趣和学习积极性。该题基础性强,旨在考查学生灵活运用基础知识解决实际问题的能力,难度不大,记住常见的热量变化即可。
本题难度:一般
2、选择题 下列关于能量转换的认识中不正确的是?
A.白炽灯工作时电能全部转变成光能
B.煤燃烧时化学能主要转变成热能
C.绿色植物光合作用过程中太阳能转变成化学能
D.电解水生成氢气和氧气时,电能转化成化学能
参考答案:A
本题解析:白炽灯工作时电能不可能全部转变成光能,因为钨丝还发热,部分转化为热能,A不正确。其余都是正确的,答案选A。
本题难度:简单
3、选择题 断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
A.H2与F2反应的热化学方程式为:
H2(g)+F2(g)=2HF(g) ΔH=-541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
参考答案:D
本题解析:焓变ΔH的单位是kJ/mol,A项错误;依据题目提供的键能数据,可知应是
2 mol HF气体分解成1 mol H2和1 mol F2时吸收541 kJ的热量,B项错误;气态HF变为液态时要放出热量,所以1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量大于541 kJ,C项错误;H2与F2的反应是放热反应,说明在相同条件下,反应物的总能量大于生成物的总能量,D项正确。
本题难度:一般
4、简答题 Ⅰ.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭______,(2)给手机的电池充电______,
(3)用蓄电池点亮灯泡______,(4)电解水得到O2和H2______.
Ⅱ.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5
氢气体积(mL)
30
120
280
350
370
|
(1)①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为______.原因是______
②反应速率最小的时间段为______,原因是______
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入下列物质以减慢反应速率
A.蒸馏水?B.少量CuCl2晶体?C.NaCl溶液
你认为他的做法可行的是加入______?(填相应字母);其中他的做法中也有不可行的,其不可行的理由是______.
参考答案:I.(1)烧煤煮饭是煤燃烧发生化学反应放出能量,即化学能转化为热能.
(2)给手机充电是把对手机电池中物质进行电解,使电池的物质在阴极和阳极发生化学反应,即电能转化为化学能.
(3)蓄电池给灯泡供电,是蓄电池中 的物质在正极和负极上得失电子产生电流,使灯泡发亮,即化学能转化为电能.
(4)电解水得到O2和H2,是氢离子和氢氧根离子分别在阴极得电子和在阳极失电子,发生了化学反应,即电能转化为化学能.
故答案为:化学能变热能;电能变化学能;化学能变电能;电能变化学能;
II.(1)①0~1、l~2、2~3、3~4、4~5min时间段内产生的氢气体积分别为:30mL、90mL、160mL、70mL、20mL,则2~3min时间内反应速率最大,其原因是,锌与稀硫酸反应为放热反应,随反应的进行,放出的热量使溶液温度升高,而升高温度会加快反应速率,即由于反应放热,溶液温度升高,反应速率加快.故答案为:2~3?min;由于反应放热,溶液温度升高,反应速率加快;
②根据①的计算可以看出,4~5?min时间段内放出的气体体积最少,反应速率最小,其原因是,随反应的进行,尽管溶液温度较高,但硫酸的难度会逐渐减小,而减小浓度,会使反应速率减小,即硫酸浓度降低,导致反应速率减慢.故答案为:4~5?min;硫酸浓度降低,导致反应速率减慢;
(2)为了减慢反应速率,可以降低反应温度、减低反应物的浓度,加入蒸馏水可以扩大硫酸溶液的体积而降低其浓度,加入NaCl溶液时,NaCl不参与反应,但会稀释硫酸,降低硫酸的浓度.因此能降低反应速率的有AC;当加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,锌、铜与硫酸会形成原电池,发生原电池反应而加快反应速率,即反应速率加快的原因是:Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应.故答案为:AC;Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应.
本题解析:
本题难度:一般
5、选择题 参照反应Br+H2 HBr+H的能量对应反应历程的示意图,下列叙述中正确的是? ( ? )
HBr+H的能量对应反应历程的示意图,下列叙述中正确的是? ( ? )
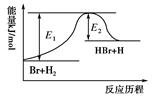
A.正反应为吸热反应
B.吸热反应一定要加热后才能发生
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速
参考答案:A
本题解析:根据图像可知,反应物的总能量低于生成物的总能量,所以这是一个吸热反应。反应是放热还是吸热与反应条件无关,所以A正确,BC不正确。升高温度,反应速率一定增大,不论是正反应速率还是逆反应速率,D不正确。答案选A。
本题难度:一般