微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是?
[? ]
A.所有的酸、碱中和反应的离子方程式都一样
B.所有的离子方程式都可表示一类反应
C.单质和氧化物在离子方程式中不用离子符号表示
D.易溶于水的化合物都可写成离子形式
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列离子方程式与所述事实相符且正确的是(? )
A.Ca(OH)2悬浊液中滴加足量稀硝酸:H++OH-=H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O
C.硫酸氢钠溶液中加入Ba(OH)2溶液至SO42-恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
参考答案:D
本题解析:A项错误,Ca(OH)2不可拆。B项不符合客观事实,Ca(HCO3)2溶液中加入少量NaOH溶液,HCO3-有剩余。C.硫酸氢钠溶液中加入Ba(OH)2溶液至SO42-恰好完全沉淀应为:Ba2++OH-+H++SO42-=BaSO4+H2O,C项错误。D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 Cl2过量,正确。
本题难度:一般
3、选择题 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为2KMnO4+10FeSO4+ 8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。
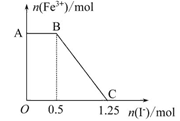
则下列有关说法不正确的是(? )
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色
参考答案:D
本题解析:加入KI溶液后,AB段,Fe3+的物质的量不变,说明高锰酸钾溶液与硫酸亚铁溶液反应后高锰酸钾过量,根据电子守恒可知,过量的n(KMnO4)为0.5 mol÷5="0.1" mol。继续加入KI溶液,Fe3+的物质的量减少,发生反应2Fe3++2I-=2Fe2++I2,反应的n(Fe3+)="0.75" mol,所以生成0.75 mol Fe3+消耗的n(KMnO4)为0.75 mol÷5="0.15" mol,则开始加入的高锰酸钾的物质的量为0.25 mol。C点以后的溶液中不再含有Fe3+,加入少量KSCN溶液,溶液颜色不变
本题难度:一般
4、选择题 在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜。表示这个氧化还原反应的离子方程式是
[? ]
A.?Cu2++3I-===CuI↓+I2?
B.?Cu2++2I-===Cu++I2
C.?2Cu2++2I-===2Cu++I2?
D.?2Cu2++4I-===2CuI↓+I2
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.Cl2与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O
B.氢氧化镁与硫酸溶液反应OH-+H+=H2O
C.碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.澄清石灰水中加入碳酸钠溶液:Ca2++CO32-═CaCO3↓
参考答案:A.Cl2与NaOH溶液反应的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故A错误;
B.氢氧化镁与硫酸溶液反应的离子反应为Mg(OH)2+H+=H2O+Mg2+,故B错误;
C.碳酸钙与醋酸溶液反应的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故C错误;
D.石灰水中加入碳酸钠溶液反应的离子反应为Ca2++CO32-═CaCO3↓,故D正确;
故选D.
本题解析:
本题难度:一般