| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的量》高频试题预测(2017年最新版)(四)
参考答案:D 本题解析:设浓盐酸的体积为Vml,则Vml×1.2g?cm-3×36.5%=1mol?L-1×0.1L×36.5g/mol,解得:V=8.33ml,所以量取时用10mL量筒,一般用量筒量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以需要的仪器为:10mL量筒、50mL烧杯、玻璃棒、100mL容量瓶、胶头滴管,故D项正确。 本题难度:一般 3、计算题 (12分) 参考答案:(1)3.01×1023(2分) 3.01×1024(2分) 本题解析: 本题难度:一般 4、选择题 在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到cmol NH3,则原溶液中的Al3+浓度(mol/L)为 [? ] A.  B.  C. 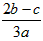 D.  参考答案:C 本题解析: 本题难度:一般 5、选择题 25℃时,下列各溶液中有关物质的量浓度关系不正确的是 参考答案:A 本题解析: 本题难度:简单 |
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《与量有关的离子方.. | ||