微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在25°C时,将两个铜电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阴极上逸出amol气体,同时析出w克Na2SO4?10H2O晶体,若保持温度不变,此时剩余溶液的质量分数是( )
A.
%
B.%
C.%
D.%
参考答案:电解饱和硫酸钠溶液时,阳极上Cu放电,阴极上氢离子放电生成氢气,发生反应Cu+2H2O通电.Cu(OH)2+H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,
wgNa2SO4?10H2O硫酸钠的质量=wg×142322=71w161g;
设电解水的质量为x:
Cu+2H2O通电.Cu(OH)2+H2↑
36g 1mol
xamol
x=36ag
所以饱和溶液的质量分数=71w161gwg+36ag×100%=7100w161(w+36a)%,
故选D.
本题解析:
本题难度:简单
2、填空题 按下图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为____,B池为____。
(2)锌极为____极,电极反应式为____;铜极为_____极,电极反应式为__________ 、____________ ;石墨棒C1为____极,电极反应式为____;石墨棒C2附近发生的实验现象为________。
(3)当C2极析出224 mL气体(标准状况下),锌的质量变化为(增加或减少)__________g。CuSO4溶液的质量变化为(增加或减少)__________g。
参考答案:(1)原电池 ;电解池
(2)负; Zn-2e-==Zn2+ ;正 ;Cu2+ + 2e-==Cu ;阳 ;2Cl- - 2e- == Cl2↑ ;有无色气体产生;附近溶液出现红色
(3)减少0.65 ;增加0.01
本题解析:
本题难度:一般
3、填空题 (9分)下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
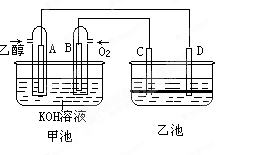
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为 。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应 。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
参考答案:(1)C2H5OH+16OH--12e-=2CO32-+11H2O (2分)
4OH--4e-=2H2O+O2↑ (2分)
(2)C (1分) 2I--2e?=I2 (2分)
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-1366.7kJ/mol (2分)
本题解析:(1)通入乙醇的电极为原电池的负极,乙醇失去电子生成碳酸根离子,电极反应为:C2H5OH+16OH--12e-=2CO32-+11H2O。充电时,B极为电解池的阳极,是溶液中的氢氧根离子放电,电极反应为:4OH--4e-=2H2O+O2↑。(2)根据现象分析,乙池中产生了碘单质,所以碘单质是由碘离子是失去电子生成的,所以应该在电解池的阳极生成,则应和原电池的正极连接,所以为C极。电极反应为:2I--2e?=I2。(3)根据1克乙醇燃烧放出29.7kJ的热量,计算1摩尔乙醇燃烧放出的热量为29.7×46=1366.7kJ,所以热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-1366.7kJ/mol。
考点:原电池的电极反应,电解原理的应用,热化学方程式的书写。
本题难度:困难
4、选择题 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为:KI+H2O→KIO3+H2↑.下列有关说法中,正确的是( )
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
参考答案:A、反应式为:KI+H2O→KIO3+H2↑,阳极是惰性电极,所以电解时,石墨做阳极,铁作阴极,故A正确;
B、依据反应原理,电解时阴极产生氢气,故B错误;
C、碘酸钾溶液浓缩蒸干结晶,得到的晶体灼烧碘酸钾会分解,故C错误;
D、化学方程式,KI+3H2O→KIO3+3H2↑,转移电子数6mol,生成1mol碘酸钾;每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体,故D正确;
故选AD.
本题解析:
本题难度:一般
5、选择题 用惰性电极电解一定量的硫酸铜溶液,实验装置如图①.电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).则下列说法正确的是( )

A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H++2e-=H2↑和?4OH--4e-=2H2O+O2↑
C.从P到Q点时收集到的混合气体的平均摩尔质量为12g?mol-1
D.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化
参考答案:由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O?电解?.?2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O?电解?.?2H2↑+O2↑,
A.b为阳极,溶液中的氢氧根离子放电,则不会有红色物质析出,故A错误;
B.a为阴极,先发生Cu2++2e-=Cu,后发生2H++2e-=H2↑,故B错误;
C.到Q点时收集到的混合气体为氢气和氧气,由电解水反应可知0.2mol电子通过时生成0.1molH2、0.05molO2,则混合气体的平均摩尔质量为0.1mol×2g/mol+0.05mol×32g/mol0.1mol+0.05mol=12g?mol-1,故C正确;
D.由上述分析可知,曲线0~P段表示O2的体积变化,曲线P~Q段表示H2和O2混合气体的体积变化,故D错误;
故选C.
本题解析:
本题难度:简单