微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若按图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是( )
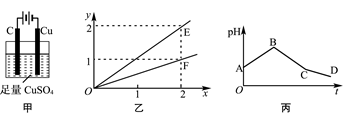
A.E表示反应生成Cu的物质的量
B.F表示反应生成H2SO4的物质的量
C.BC段阳极产物是Cl2
D.CD段电解的物质是水
参考答案:BD
本题解析:甲装置为电解装置,电解硫酸铜的电极反应式分别为:C(阳极)4OH——4e—=O2+2H2O;
Cu(阴极)2Cu2++4e—= 2Cu;总反应方程式为: 2CuSO4+2H2O===2Cu+ O2+2H2SO4;
即A错,E表示反应生成H+的物质的量;B正确,F表示反应生成H2SO4的物质的量;
若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液即相当于溶液存在等物质的量的CuSO4和NaCl,电解时,第一阶段AB段为电解CuCl2(溶液中铜离子浓度减少,溶液的PH增大),第二阶段为BC段电解CuSO4(溶液中氢离子浓度增大,PH减小),阳极为氢氧根离子放电,产物为O2;第三阶段为CD段电解水(溶液中氢离子浓度增大,PH再减小);
即C错,D正确;
本题难度:一般
2、填空题 下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。
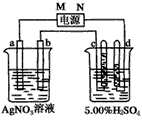
通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:
2∶____________∶____________∶____________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,AgNO3溶液的pH
____________,H2SO4溶液的浓度____________,H2SO4溶液的pH____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为____________g。
参考答案:(1)正
(2)Ag;2.16
(3)2∶0.5∶1
(4)不变;不变;增大;减小
(5)45.18
本题解析:
本题难度:一般
3、选择题 将含有0.4molNaCl和0.5mol?Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol?Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L
参考答案:将含有0.4mol?NaCl和0.5mol?Cu(N03)2的水溶液1L,用惰性电极电解,溶液中的阳离子有Cu2+、H+、Na+;移向阴极,发生的电极反应为:Cu2++2e-=Cu
阴离子Cl-、OH-、NO3-;移向阳极;电极反应为:2Cl--2e-=Cl2↑,0.3molCu生成转移电子为0.6mol;溶液中氯离子物质的量为0.4mol,全部反应失去电子物质的量为0.4mol,生成氯气为0.2mol,还有0.2mol电子是氢氧根离子失去发生电极反应为:4OH--4e-=2H2O+O2↑生成氧气为0.05mol,所以共生成气体标准状况下生成气体体积为(0.05mol+0.2mol)×22.4L/mol=5.6L;
故选B.
本题解析:
本题难度:简单
4、选择题 用铂作电极电解1000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。下列有关叙述正确的是(NA代表阿伏加德罗常数的值)
A.电解过程中流经外电路的电子数目为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液的pH为2(假设溶液体积不变)
D.加入13.8 g Ag2CO3可将溶液彻底复原