微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9;单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________(用元素符号表示)。
(2)ZW2的分子式为________________。
(3)工业生产单质Y的原理是__________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是___________________________________________________。
(5)0.1 mol的单质W与50 mL 1.5 mol·L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是______。
参考答案:(1)Cl<S<Al
(2)SCl2
(3)2Al2O3(熔融)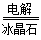 4Al+3O2↑
4Al+3O2↑
(4)Be+2NaOH=Na2BeO2+H2↑
(5)3∶5
本题解析:根据X为四种原子中原子序数最小的短周期元素,且X原子最外层电子数与次外层电子数相等可知,X为Be。X与W最外层电子数之和为9,且W为四种元素中原子序数最大的元素可知,W为Cl。又因为单质Y能与浓NaOH溶液反应,结合四种元素中只有两种金属元素,所以Y为Al,再根据Y与Z最外层电子数之和为9,推断Z为S。工业生产Al采用电解溶融的Al2O3的方法。Be与Al性质相似,具有两性,Be+2NaOH=Na2BeO2+H2↑。还原性强弱顺序为Fe2+>Br-,n(Cl2)=0.1 mol、n(Fe2+)=0.075 mol,n(Br-)=0.15 mol。可知Cl2能氧化全部Fe2+和部分Br-,设被氧化的Br-的物质的量为x,根据得失电子相等,0.1 mol×2=0.075 mol+x,x=0.125 mol,即n(Fe2+)∶n(Br-)=0.075 mol∶0.125 mol=3∶5。
本题难度:一般
2、选择题 与OH?具有相同质子数和电子数的粒子是:
A.F?
B.C1?
C.NH3
D.H2O
参考答案:A
本题解析:OH?的质子数和电子数分别是9和10,所以选项A正确。B中质子数和电子数分别是17和18,CD中质子数和电子数都是10个,答案选A。
本题难度:一般
3、选择题 俄国化学家门捷列夫为化学的发展做出过十分重要的贡献,在前人研究的基础上,他于1869年提出了:
A.原子学说
B.分子学说
C.等电子体学说
D.元素周期律
参考答案:D
本题解析:略
本题难度:简单
4、选择题 某种元素R的核外电子数等于核内中子数,取该元素5.6g跟氧气充分反应,可得到12g化合物RO2,则该种元素R在周期表中的位置是
A.第二周期第ⅣA族
B.第三周期第ⅣA族
C.第三周期第ⅥA族
D.第二周期第ⅥA族
参考答案:B
本题解析:核外电子数等于核内中子数,则核外电子数就是质量数的一半,主要就是碳、硅两种元素。设该元素的质量数为M,那么相对原子质量也可以看做为M。则该元素单质物质的量为5.6/M mol,则最后得到的化合物也为5.6/M mol,则该化合物的相对分子质量为12*M/5.6。而从化合物组成出发,化合物的相对分子质量也可以通过M+32计算,所以得出等式:
12*M/5.6= M+32,解此式得到:M=28,则该元素为硅。位置在第三周期第ⅣA族
点评:本题的做法是先由核外电子数等于核内中子数来确定元素的范围,然后根据化合物相对分子质量来计算,当然此题也可以使用差量法。计算过程中注意细节。
本题难度:简单
5、选择题 几种短周期元素的原子半径及主要化合价如下表所示:下列叙述正确的是:
元素代号
| L
| M
| J
| Q
| R
| T
|
原子半径/nm
| 0.186
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
|
最高正化合价
| +1
| +2
| +3
| +6
| +2
| 不常见
|
负化合价
| 无
| 无
| 无
| -2
| 无
| -2
|
A. T、Q的氢化物在通常情况下均为无色气体?
B. L、M、J的单质与水反应的速率:J>M>L
C. J的最高价氧化物及其对应的水化物均具有两性?
D. L、Q、T形成的简单离子的半径:Q>L>T
参考答案:C
本题解析:L、M、J、Q、R、T分别为Na、Mg、Al、S、Be、O;所以A错误,因为T的氢化物为水,在通常情况下为液体,B错误,因为L、M、J的单质与水反应的速率:L>M>J,D错误,因为L、Q、T形成的简单离子的半径:Q>T>L,J为Al,其最高价氧化物及其对应的水化物均具有两性,所以答案为C。
点评:本题考查了元素周期表,是高考考查的热点,本题具有一定的综合性,比较复杂,有一定的难度。
本题难度:简单