微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 同温同压下,在4支相问体积的试管巾分別充有等体积的2种气体,它们是(1 ) NO和 O2 ( 2 ) NO2和 O2 ( 3 ) NO和 NO2 ( 4 )HCl和N2。现将4支试管均倒置于水槽中,充分反应后剩余气体的体积分别是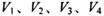 ,则下列关系正确的是
,则下列关系正确的是
A.
B.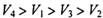
C.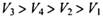
D.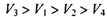
参考答案:C
本题解析:设试管体积均为V,分别根据反应方程式计算:(1)剩余V/8的氧气。(2)剩余3V/8的氧气。(3)为2V/3的NO。(4)余下V/2的氮气。故选C
本题难度:一般
2、实验题 实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通过灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO?2)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、
酒精灯等未列出):

请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)
_________作发生装置,该反应的化学方程式_________________________。
要制取并收集纯净的氮气(可含有少量的水),还应使用上述仪器中的(填仪器的编号,
并按气流方向从左向右列出)_______________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。
这两种方法与方法三相比,其优越性在于①____________?______________________,
②_________________________________________。(至少写两点)
参考答案:(1)E? CaO+NH3·H2O==Ca(OH)2+NH3↑
或CaO+H2O==Ca(OH)2? NH3·H2O==NH3↑+H2O? E→F→A→C→D(不用C也可)?(2)①节约原料,Cu可循环利用?②产物为N2和H2O,对环境无污染
本题解析:(1)氨水是液体,生石灰是固体,属于固体互溶液体反应制取气体的,因此选择E装置,方程式为CaO+NH3·H2O==Ca(OH)2+NH3↑。氮气的密度和空气接近,应该用排水法收集。和氧化铜反应的氨气应该是干燥的,所以需要先干燥氨气,所以正确的顺序是E→F→A→C→D。
(2)一方面Cu可循环利用,节约原料;另一方面产物为N2和H2O,对环境无污染。
本题难度:一般
3、填空题 (1)舞台上的幕布与布景多是用浓NH4Cl溶液浸过制成的,可以防火,其原因是_____________________________。
(2)已知NH3结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂是_______,实现转化的离子方程式为______________________________________。
(3)氮的氧化物NOx与NH3反应生成N2和H2O,若在标准状况下1.5 L NOx和2 L NH3恰好完全作用,写出反应的化学方程式:____________________________,NOx中x值为___________。
参考答案:(1)NH4Cl受热分解时吸收热量而降低体系温度,同时分解产生的NH3和HCl能隔绝空气
(2)HNO3?[Ag(NH3)2]++2H+====Ag++2NH
(3)6NOx+4xNH3====(3+2x)N2+6xH2O? 2
本题解析:(1)从NH4Cl受热分解产生NH3和HCl考虑。?(2)据题给信息应加H+,但不能用HCl和H2SO4,因为Cl-、SO 能与Ag+结合。由NOx与NH3反应的体积比求x的值:1.5∶2=6∶4x,解得x=2。
能与Ag+结合。由NOx与NH3反应的体积比求x的值:1.5∶2=6∶4x,解得x=2。
本题难度:简单
4、实验题 如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法?。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
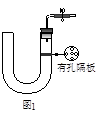
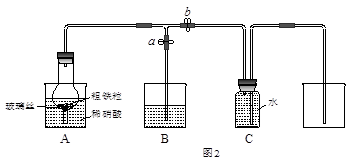
(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、?。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是?。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤
| 操作
| 现象与结论
|
第一步
| 取少量液体装于试管,向试管中滴入几滴KSCN溶液。
| ?
|
第二步
| ?
| 若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
|
?
参考答案:(1)关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好(没有关闭止水夹不得分)(2分)
(2)不溶于水的块状固体,不需要加热(2分)
(3)2.95mol·L-1(2分,没单位不得分)?
500mL容量瓶、胶头滴管(2分,各1分,其中500mL容量瓶只答容量瓶不给分)
(4)铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体(2分,只要答出红棕色气体即给2分)?吸收二氧化氮(2分)
(5)若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+(1分)
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液(1分)
本题解析:(1)利用气体压强来检验装置的气密性,具体操作:关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好
(2)图1相当于简易启普发生器装置,可适用的反应条件和反应物状态为不溶于水的块状固体,不需要加热
(3)利用溶液中溶质质量分数与物质的量浓度的换算关系,得稀硝酸的物质的量浓度为1000ml·L-1×1.10 g·cm-3×16.9%/63g·mol-1=2.95mol·L-1,配制500ml的溶液还需500mL容量瓶、胶头滴管
(4)装置中存在空气,所以实验开始时看到A中铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体,B装置中液体的作用是除去二氧化氮气体
(5)铁元素的价态一般为+2、+3,加入KSCN溶液,若有溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;紫色溶液为高锰酸钾溶液,所以第二步中操作为取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液
本题难度:困难
5、选择题 一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后的产物再溶于水可得Z溶液,Y和Z溶液反应又可生成X,则盐X是?(?)。
A.(NH4)2SO4
B.NH4Cl
C.NH4NO3
D.NH4HCO3
参考答案:C
本题解析:盐X与烧碱混合共热,可放出无色气体Y,这说明X一定是铵盐,Y一定是氨气。氨气经一系列氧化后的产物再溶于水可得硝酸,硝酸和氨气反应生成硝酸铵,据此可知答案选C。
点评:化学推断题是一类综合性较强的试题,它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般