|
高考化学试题《电解池原理》考点预测(2017年强化版)(二)
2017-03-05 15:00:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移
B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022
C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022
|
参考答案:A
本题解析:A.电解法精炼铜,阴极是铜离子放电,则当阴极质量增加32 g即0.5mol铜时,转移0.5mol×2=1mol电子,即一定有6.02×1023个电子转移,A正确;B.碳酸钠溶于水碳酸根水解生成碳酸氢根和氢氧根,则含10.6 g Na2CO3即0.1mol碳酸钠的溶液中,所含阴离子总数大于6.02×1022,B错误;C.乙烯和氮气的相对分子质量相等,都是28,则28 g由乙烯和氮气组成的混合气体的物质的量是1mol,则含有的原子个数大于2×6.02×1023,C错误;D.浓硫酸与铜反应时浓度逐渐降低,稀硫酸与铜不反应,则含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于6.02×1022,D错误,答案选A。
考点:考查阿伏加德罗常数的计算
本题难度:一般
2、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
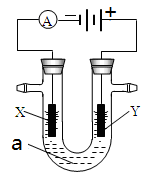
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 &# 160; 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
参考答案:(1) ① 2H++2e-=H2↑ ; 放出气体,溶液变红。
② 2Cl
本题解析:
本题难度:一般
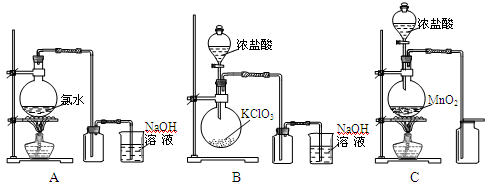
3、实验题 (17分)氯气在工农业生产中应用非常广泛。请回答以下问题:
(1)下面是三位同学分别设计的实验室制取和收集氯气的装置,其中最好的是 (填序号):
(2)某课外小组同学用如图所示装置通过电解食盐水并探究氯气相关性质,请回答:
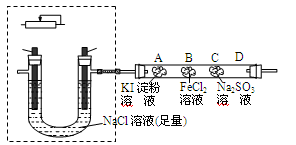
①现有电极:C和Fe供选择,请在虚框中补画导线、电源( ),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。 ),串联变阻器以调节电流,同时标出电极材料;电解的离子反应方程式为 。
②通电一段时间后,玻璃管A、B、C三处是浸有不同溶液的棉花,其中A、B两处的颜色变化分别为 、 ;C处发生的离子反应方程式为 。
③为防止氯气逸出造成污染,应采取的措施是 。
(3)当在阴极收集到气体448mL(标准状况)后停止实验,将U形管溶液倒于量筒中测得体积为400mL,则摇匀后理论上计算得溶液pH= 。
参考答案:(1)(2分)B
(2)①见右图: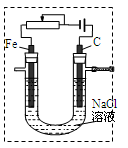 (2分) 2Cl-+2H2O====Cl2↑+H2↑+2OH-(3分) (2分) 2Cl-+2H2O====Cl2↑+H2↑+2OH-(3分)
②无色变蓝色(2分)、浅绿色变黄色(2分)
Cl2+SO32-+H2O==2Cl-+ SO42-+2H+(2分)
③在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中。2分)
(3)(2分)13
本题解析:(1)氯气在水中的溶解度不大,A装置用加热氯水的方法制氯气得到的氯气较少;氯气有毒,应进行尾气处理,装置C缺少尾气处理装置;实验室制取和收集氯气的装置最好的是B;(2)①通过电解食盐水制备氯气并探究氯气相关性质,氯气为阳极产物,产生氯气的电极应与电源的正极相连,装置图见答案;电解的离子反应方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-;②通电一段时间后,玻璃管A处氯气与碘化钾反应生成单质碘,碘遇淀粉变蓝色;B处氯气与氯化亚铁反应生成氯化铁,由浅绿色变黄色;C处氯气与亚硫酸钠溶液反应生成硫酸钠和盐酸,发生的离子反应方程式为Cl2+SO32-+H2O==2Cl-+ SO42-+2H+;③为防止氯气逸出造成污染,应采取的措施是在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中);(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O Cl2↑+H2↑+2OH-;②通电一段时间后,玻璃管A处氯气与碘化钾反应生成单质碘,碘遇淀粉变蓝色;B处氯气与氯化亚铁反应生成氯化铁,由浅绿色变黄色;C处氯气与亚硫酸钠溶液反应生成硫酸钠和盐酸,发生的离子反应方程式为Cl2+SO32-+H2O==2Cl-+ SO42-+2H+;③为防止氯气逸出造成污染,应采取的措施是在D处放一团浸有NaOH溶液的棉花(或将尾气通入盛有NaOH溶液的烧杯中);(3)阴极收集到的气体为H20.448L,n(H2)=0.448L÷22.4L/mol=0.02mol;由方程式:2Cl-+2H2O Cl2↑+H2↑+2OH- 得: Cl2↑+H2↑+2OH- 得:
n(OH-)=0.02mol×2=0.04mol;c(OH-)="0.04mol÷0.4L=0.1mol/L" 则pH=14-(-lg10-1)=13。
考点:考查氯气的制备和性质,电解原理的应用。
本题难度:困难
4、选择题 溶液中含有两种溶液质—氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是
A.阴极只析出氢气
B.阳极先析出氯气后析出氧气
C.电解最后阶段为电解水
D.电解过程中溶液的PH不断增大,最后pH为7
参考答案:D
本题解析:根据题意可知,可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,也可以看成2molHCl,1molNa2SO4,1molNaCl。由于1molNa2SO4自始至终无法电解,且其溶液pH=7,暂时可以忽略,因此电解过程可先看成电解HCl,再电解NaCl,最后电解水,即2HCl H2↑+Cl2↑,2NaCl+2H2O H2↑+Cl2↑,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,2H2O 2NaOH+H2↑+Cl2↑,2H2O 2H2↑+O2↑,生成的NaOH为强碱,溶液显进行,pH大于7。A中阴极自始自终是氢离子放电,只析出H2,故A正确;B中阳极氯离子先于氢氧根离子放电,先析出Cl2,后析出O2,故B正确;故B错误;C中电解最后阶段为电解水,故C正确;D中溶液pH不断增大,最后生成的NaOH为强碱,pH大于7,因此D不正确,答案选D。 2H2↑+O2↑,生成的NaOH为强碱,溶液显进行,pH大于7。A中阴极自始自终是氢离子放电,只析出H2,故A正确;B中阳极氯离子先于氢氧根离子放电,先析出Cl2,后析出O2,故B正确;故B错误;C中电解最后阶段为电解水,故C正确;D中溶液pH不断增大,最后生成的NaOH为强碱,pH大于7,因此D不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中,侧重对学生能力的培养与基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确溶液中离子的放电顺序,然后依据题意灵活运用即可。
本题难度:简单
5、选择题 用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、降低的是(? )
A.AgNO3 CuCl2 Cu(NO3)2
B.KCl Na2SO4 CuSO4
C.CaCl2 KOH NaNO3
D.HCl HNO3 K2SO4
参考答案:B
本题解析:由电解规律可得:
类型
化学物质
pH变化
放O2生酸型
CuSO4、AgNO3、Cu(NO3)2
降低
放O2生酸型
KCl、CaCl2
升高
电解电解质型
CuCl2
升高
HCl
升高
电解H2O型
NaNO3、Na2SO4、K2SO4
不变
KaOH
升高
HNO3
降低
?
故选B。
本题难度:一般
|