微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是(?)?
A.D >C >A >B?B. D >A >B >C
C.D >B >A >C?D.B >A >D >C
2、填空题 (8分)
如图所示,是原电池的装置图(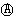 为电流表)。请回答:
为电流表)。请回答:
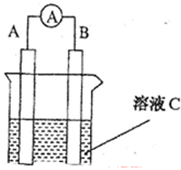
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为 。
3、填空题 在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如下图所示:
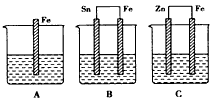
(1)A中反应的离子方程式为_________________________。
(2)B中Sn极的电极反应式为_________________________,Sn极附近溶液的pH____(填“增大”、“减小”或“不变”)。
(3)C中被腐蚀的金属是___,总反应式为__________________________(写离子方程式)。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_______________。
4、填空题 (14分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下, 与空气反映t min后,
与空气反映t min后, 和
和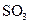 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则 起始物质的量浓度为 mol/L ;生成
起始物质的量浓度为 mol/L ;生成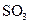 的化学反应速率为 mol/(L·min) .
的化学反应速率为 mol/(L·min) .
②工业制硫酸,尾气 用_______吸收.
用_______吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.
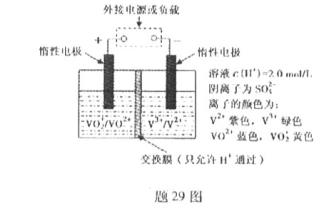
①当左槽溶液逐渐由黄变蓝,其电极反应式为 .
②充电过程中,右槽溶液颜色逐渐由 色变为 色.
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为 .
1023个,左槽溶液中n(H+)的变化量为 .
5、选择题 银器皿日久表面逐渐变黑,这是因为生成了Ag2S.有人设计用原电池原理除去银器表面的黑色.方法为:将其与Al片接触,一起浸泡在稀NaOH溶液中,放置一段时间后黑色褪去,取出用水洗净,恢复其原貌.总反应为2Al+3Ag2S+8OH-═2AlO
+6Ag+3S2-+4H2O
下列叙述不正确的是( )
A.反应后溶液的pH降低
B.溶液中的OH-离子向正极移动
C.负极的电极反应式为:2Al+8OH--6e-═2AlO+4H2O
D.正极的电极反应式为:3Ag2S+6e-=═6Ag+3S2-