微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某科研所欲检测一合金的成分,特做如下实验:取该合金64克,与足量的氯气完全反应,消耗氯气71克,则合金的组成可能是
A.Cu、Zn
B.Na、Zn
C.Fe、Ca
D.Cu 、Ca
参考答案:B
本题解析:氯气是71g,物质的量是1mol,则反应中转移2mol电子。因此每转移1mol电子消耗金属的质量应该是Cu:32g、Zn:32.5g、Na:23g、Fe:56÷3=18.7g、Ca:20g。由于合金的质量是64g,则每转移1mol电子平均消耗金属的质量是64g÷2=32g,所以只有选项B正确,答案选B。
点评:本题属于中等难度的试题,对学生的思维能力要求较高。该题也可以通过常规做法,即分别计算出消耗1mol氯气时需要金属的质量,然后通过对比也可以得出正确的答案。
本题难度:简单
2、选择题 下列变化属于氧化还原反应的是(? )
A.溴化银感光
B.碘的升华
C.液溴挥发
D.氧化铜溶于盐酸
参考答案:A
本题解析:2AgBr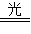 ?2Ag+Br2;? CuO+2H+====Cu2++H2O。
?2Ag+Br2;? CuO+2H+====Cu2++H2O。
本题难度:简单
3、填空题 用滴管将新制的饱和氯水慢慢滴入加有酚酞的NaOH稀溶液中,当滴加到最后一滴时红色突然褪去,
试回答:
(1)产生上述现象的原因可能是:______________;______________。
(2)怎样用实验证明红色褪去的原因是______________。
参考答案:(1)NaOH被H+中和,碱性减弱使红色褪去;酚酞被HClO氧化为无色而导致红色褪去
(2)向已褪色的溶液中再滴入几滴NaOH溶液,如果出现红色,则证明是H+与NaOH中和导致褪色,如果不出现红色,则证明是HClO将酚酞氧化为无色而导致红色褪去
本题解析:
本题难度:一般
4、选择题 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲中加入少量的碳酸氢钠晶体m mol,在乙中加入少量的亚硫酸氢钠晶体m mol,丙瓶不变,片刻后,甲乙丙三溶液中HClO的物质的量浓度大小关系是(溶液体积变化不计)(?)
A.甲=乙>丙
B.甲>丙>乙
C.丙>甲=乙
D.乙>丙>甲
参考答案:B
本题解析:氯水中存在平衡Cl2+H2O HCl+HClO。次氯酸的酸性其余碳酸氢钠的,所以甲中加入碳酸氢钠只和盐酸反应,促进平衡向向正反应方向移动,次氯酸浓度增大;亚硫酸氢钠具有还原性,次氯酸钠氧化亚硫酸氢钠,所以乙中次氯酸的浓度降低,即答案选B。
HCl+HClO。次氯酸的酸性其余碳酸氢钠的,所以甲中加入碳酸氢钠只和盐酸反应,促进平衡向向正反应方向移动,次氯酸浓度增大;亚硫酸氢钠具有还原性,次氯酸钠氧化亚硫酸氢钠,所以乙中次氯酸的浓度降低,即答案选B。
本题难度:一般
5、选择题 取三张蓝色石蕊试纸放在表面皿上,然后按顺序分别滴加65%的浓硝酸、98%的浓硫酸和新制的氯水,三张试纸最后呈现的颜色是(? )
A.白、红、白
B.白、黑、白
C.红、红、红
D.红、黑、红
参考答案:B
本题解析:浓硝酸和氯水具有漂白性,所以当滴加到蓝色石蕊试纸上时,试纸会变为白色,浓硫酸具有脱水性,所以当滴加在蓝色石蕊试纸上时,试纸会变为黑色,所以答案选B。
本题难度:简单