微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)已知在常温下,常见弱酸和弱碱的电离平衡常数如下表所示:
| 电解质 | HF | CH3COOH | HNO2 | NH3?H2O
电离平衡常数K
3.53×10-4
1.76×10-5
4.6×10-4
1.77×10-5
|
浓度均为0.1mol?L-1的下列5种溶液:①CH3COONH4 ②CH3COONa ③NaNO2④HF⑤NH4Cl,溶液pH值由小到大的顺序是(填写编号)______.
(2)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl-
浓度/mol?L-1
4×10-6
6×10-6
2×10-5
4×10-5
3×10-5
2×10-5
|
根据表中数据计算试样的pH=______.
(3)如图表示某溶液中c(H+)和c(OH-)的关系,下列判断正确的是______(用编号填写)
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.AB线上任意点均有pH=7
C.图中T1<T2
D.M区域内(阴暗部分)任意点均有c(H+)>c(OH-)
(4)pKa表示的是弱电解质电离平衡常数的负对数,即pKa=-lgKa,有关数据如下:
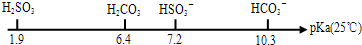
①0.01mol?L-1 NaHSO3溶液的pH=bl,0.01mol?L-1 NaHCO3溶液的pH=b2,b1______b2(填“<”“>”“=”)
②向10mL0.01mol?L-1的H2SO3溶液中,滴加0.0lmol?L-1 KOH溶液10mL,溶液中存在c(H+)>c(OH-),则以下四种微粒K+、H2SO3、HSO3-、SO32-,其浓度由大到小的顺序为______.

参考答案:(1)水解呈碱性的有②CH3COONa ③NaNO2,酸的Ka越大,酸越强,对应盐水解程度越小,其PH越小,则pH:②>③;
水解呈酸性的有:⑤NH4Cl;
水解呈中性有:①CH3COONH4,醋酸和NH3?H2O的电离常数基本相当,所以CH3COONH4水解显中性;
酸有:④HF,
由于水解程度较小,所以水解产生的氢离子浓度小于电离产生的氢离子浓度;所以溶液pH值由小到大的顺序是④⑤①③②;
故答案为:④⑤①③②;
(2)溶液中电荷守恒:C(K+)+C(NH4+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-),得C(H+)=1×10-4mol?L-1,pH值为4,
故答案为:4;
(3)A.只要是水溶液中,都会有c(H+)×c(OH-)=Kw,故A正确;
B.AB连线是一条Kw渐渐变大的线,pH也变大,故B错误;
C.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大,B点Kw大于A点,所以T1<T2,故C正确;
D.AB连线的斜率是1,存在c(H+)=c(OH-),在AB连线的上方,c(H+)<c(OH-),在AB连线的下方,c(H+)>c(OH-),故D错误;
故答案为:AC;
(4)①由pKa数据可知,亚硫酸的pKa小于碳酸,则酸性比碳酸的强,相同浓度的NaHSO3溶液比NaHCO3溶液中酸根离子的水解程度弱,则NaHSO3溶液的pH小,即bl<b2,故答案为:<;
②反应后溶液的溶质为KHSO3,又KHSO3溶液呈酸性,则HSO3-的电离大于其水解,电离生成SO32-离子,水解生成H2SO3,则c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),故答案为:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3).
本题解析:
本题难度:一般
2、填空题 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是?。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是?。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是?。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是?。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为?,反应所需时间的长短关系是?。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是?。
参考答案:(1)b>a>c (2)b>a=c (3)c>a>b(或c>a=2b) (4)c>a=b (5)a=b=c a=b>c (6)c>a=b
本题解析:(1)氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),则当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c;(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;(3)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以当三者c(H+)相同时,物质的量浓度由大到小的顺序为c>a>b;(4)当三者c(H+)相同、体积相同时,盐酸、硫酸完全电离,只有醋酸在继续电离,则分别加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b;(5)与锌反应时产生氢气的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c;反应过程中,醋酸不断电离,氢离子浓度较大,反应速率较快。反应所需时间的长短关系是a=b>c;(6)将c(H+)相同的三种酸均稀释相同倍数,盐酸、硫酸的变化相同,但醋酸为弱酸,促进电离,稀释相同的倍数时,其pH由大到小的顺序为a=b>c。
本题难度:简单
3、选择题 常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是

A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
参考答案:B
本题解析:pH=2的两种二元酸HA与HB各1mL,分别加水稀释,由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,则A、HB的电离方程式为HB H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
H++B-,故A错误;B、由图可知,稀释100倍时HA的pH变化大,且pH=4,所以HA为强酸,HB为弱酸,所以c(HB)>c(HA)=0.01mol/L,故B正确;C、NaA的水溶液显中性,离子浓度大小为c(Na+)=c(A-)>c(OH-)=c(H+),故C错误;D、由于不能确定NaA、NaB的物质的量,因此二者的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)不一定正确,故D错误,故选B。
本题难度:一般
4、填空题 (1)三种弱酸HA、H2B、HC,电离常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B
②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
则三种酸对应的电离常数分别为(请填空)
| HA | H2B | HC
Ka
Ka1
Ka2
Ka
数值
1.8×10-5
4.3×10-7
______
______
|
(2)25℃时0.1mol?L-1的H2D水溶液中,用氢氧化钠来调节溶液pH,得到含有H2D、HD-、D2-三种微粒的溶液.
①当溶液的pH=7时,c(Na+)=______(填微粒间量的关系).
②当c(Na+)=c(D2-)+c(HD-)+c(H2D)时溶液为______溶液(填物质的化学式).

(3)如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
①下列叙述正确的是______
A.此图是1.0mol?L-1?碳酸钠溶液滴定1.0mol?L-1?HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH,不宜过大或过小
②已知Ksp(CaCO3)=5.0×10-9,在10mL1mol?L-1?的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100mL,向该溶液中加入1mL1×10-4mol?L-1的CaCl2稀溶液,问是否有沉淀生成?______(填“是”或“否”)
参考答案:(1)根据溶液中强酸制弱酸的原理以及反应H2B(少量)+C-=HB-+HC,可以确定酸性强弱是:H2B>HC>HB-,
故答案为:5.6×10-11;4.9×10-10;
(2)①根据溶液中的电荷守恒:c(Na+)+c(H+)=c(HD-)+2c(D2-)+c(OH-),当溶液的pH=7时,c(H+)=c(OH-),所以c(Na+)=c(HD-)+2c(D2-),故答案为:c(HD-)+2c(D2-);
?②0.1mol?L-1的H2D水溶液中,用氢氧化钠来调节溶液pH,得到含有H2D、HD-、D2-三种微粒的溶液,说明溶液依旧呈酸性,H2D为二元酸,当加入氢氧化钠不足量时,会发生反应:NaOH+H2D=NaHD+H2O,根据物料守恒则有c(Na+)=c(D2-)+c(HD-)+c(H2D),故答案为:NaHD.
(3)①A、由图可知,pH=2时溶液中含H2CO3,而没有HCO3-、CO32-,故A错误;
B、由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误;
C、由图可知,pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;
D、由图可知,pH大于12时,溶液中主要存在CO32-,则用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上,故D正确;
故选CD;
②在10mL1mol/LNa2CO3溶液中加入某浓度的盐酸后,当调节溶液的pH=10.25时,据图中内容可以看出:HCO3-、CO32-两种成分平衡时的组成分数分别为50%,即碳酸钠和碳酸氢钠的物质的量分别是0.005mol,此时溶液的体积恰好为100mL,所碳酸钠中碳酸根的浓度是0.05mol/L,再加入1mL1×10-4mol?L-1的CaCl2稀溶液时,Qc=c(Ba2+)?c(CO32-)=0.05mol/L×10-6mol/L=5×10-8(mol/L)2,而Ksp(CaCO3)=5.0×10-9,所以Qc>Ksp,能生成沉淀,故答案为:是.
本题解析:
本题难度:一般
5、填空题 (9分)25℃时,有0.01 mol?L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
参考答案:(1)K= 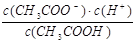 ?(2)4.18×10 -4 mol?L-1
?(2)4.18×10 -4 mol?L-1
(3)c(H+)增大?c (CH3COO-)减小?c (CH3COOH)增大?电离常数不变,因为电离常数只受温度影响,温度不变,电离常数不变
本题解析:(1)电离平衡常数和化学平衡常数是类似的,所以醋酸的电离平衡常数表达式为K= 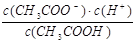 。
。
(2)醋酸的电离方程式为CH3COOH CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度
CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度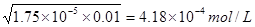 。
。
(3)电离常数和温度,所以是不变的。加入盐酸,增大氢离子的浓度,抑制醋酸的电离,所以c (CH3COO-)减小,c (CH3COOH)增大。
本题难度:一般