微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【三选一—物质结构与性质】
Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
⑴当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_______个π键。A6H6分子中A原子的杂化轨道类型是_______杂化。
⑵当n=3时,A与B形成的晶体属于_______晶体。
⑶若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
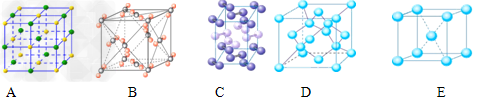
Ⅱ.⑴下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__________(请用相应的编号填写)
⑵①与N2O互为等电子体的阴离子为______________(填一种即可);②根据价层电子对互斥模型确定ClO3-离子的空间构型为______________。
⑶已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为___________。
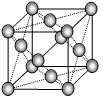
⑷下图是金属铝晶体结构的示意图。已知金属铝的密度为2.7g/cm3,则紧邻的铝原子的半径为_____________cm。(已知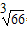 =4.04)?
=4.04)?
参考答案:Ⅰ⑴非极性;2;sp2;?⑵原子; ⑶P>S>Si
Ⅱ⑴BC;⑵①SCN-或N3-;?②三角锥形;⑶ [Ar]3d6;?⑷1.42×10-8
本题解析:
本题难度:一般
2、选择题 甲醛分子式为CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质.下列关于其结构及性质的分析正确的是( )
A.C原子采取sp3杂化,O原子采取sp杂化
B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构
C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键
D.甲醛分子为非极性分子
参考答案:C
本题解析:
本题难度:简单
3、填空题 (1)在元素周期表中,同一主族元素化学性质相似,目前也发现有些元素的化学性质和它在元素周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。
(2)有些物质如B(OH)3(硼酸)、Al(OH)3中心原子是缺电子的,即他们的中心原子最外层电子数都不满8个电子。为了使其中心原子达到8电子稳定结构,中心原子可以接受来自具有孤对电子对原子的一对电子形成特殊的共价键--即配位键,配位键可以用“→”表示,如(供出电子对)A→B(接受电子对)。正因为如此B(OH)3(硼酸)在水中也有一定的酸性,但不是本身电离出H+,而是靠夺取水中的OH-使水电离出H+从而使溶液呈现酸性。即B(OH)3+H2O=B(OH)4-+H+。根据上述信息,请回答问题:
(1)锂在空气中燃烧除生成________外,也生成微量的________(用化学式填写)。
(2)铍的最高价氧化物对应的水化物的化学式是______;属于____(填“酸性”、“碱性”或“两性”)化合物,写出能证明其性质的离子方程式是______________________。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则将Al4C3投入过量强碱溶液反应的离子方程式:____________________。
(4)科学家证实,氯化铝属于共价化合物,分子式为Al3Cl6,其结构式为下列四种中的一种,你认为正确的结构是________________。由原子间的成键特点,可以预测中心原子Al的杂化类型可能为________;若这种杂化类型成立,则处在同一平面内的原子最多有________个。

参考答案:(1)Li2O;Li3N
(2)Be(OH)2;两性;Be(OH)2+2H+=Be2+ +2H2O、Be(OH)2+2OH-=BeO22-+2H2O
(3)Al4C3+4OH-+4H2O=3CH4↑+4AlO2-
(4)④;sp3;6
本题解析:
本题难度:一般
4、选择题 氨分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
[? ]
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨分子是极性分子而甲烷是非极性分子
参考答案:C
本题解析:
本题难度:一般
5、填空题 2010年上海世博会场馆,大量的照明材 料或屏幕都使用了发光二极管( LED)。 目前市售LED品片,材质基本以GaAs (砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答

(1)镓的基态原子的电子排布式是_____________。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为__________, 与同一个镓原子相连的砷原子构成的空间构型为__________。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是__________。(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为____________。
(5)比较二者的第一电离能:As__________Ga(填“<”、“>”或 “=")。
(6)下列说法正确的是__________(填字母)。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As> Ga
D.砷化镓晶体中含有配位键
参考答案:(1)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
(2)4 正四面体
(3)NH3>AsH3>PH3
(4)sp2
(5)>
(6)BCD
本题解析:
本题难度:一般