微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验操作不能用于物质分离的是
 ?
? ?
? ?
?
A? B?C? D
参考答案:B
本题解析:过滤(A)、蒸馏(C)、分液(C)等操作常用于物质的分离。
本题难度:简单
2、填空题 用适当方法将下列混合物分离开来
(1)不溶性固体与水的混合物,如CaCO3?与水,可用______?方法分离
(2)两种互相溶解但沸点相差较大的液体,如苯和四氯化碳的混合物,可用______?方法分离
(3)可溶性固体与水的混合物.如食盐和水,可用______?方法分离
(4)两种互不相溶的液体,如水和油,可用______?方法分离.
参考答案:(1)CaCO3?与水互不相溶,可用过滤的方法分离,故答案为:过滤;
(2)苯和四氯化碳混溶,但二者的沸点不同,可用蒸馏的方法分离,故答案为:蒸馏;
(3)食盐溶于水,但蒸发时水易挥发,而实验不挥发,可用蒸发的方法分离,故答案为:蒸发;
(4)水和油互不相溶,可用分液的方法分离,故答案为:分液.
本题解析:
本题难度:简单
3、选择题 溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( ? )
A.加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出
B.加入氢溴酸并加热,使乙醇转化为溴乙烷
C.加入金属钠,使乙醇发生反应而除去
D.加水振荡,静置分层后,用分液漏斗分离去水层
参考答案:D
本题解析:乙醇和水互溶,而溴乙烷难溶于水,所以可以利用萃取原理进行分离,加水振荡,静置分层后,用分液漏斗分离去水层,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。该题需要注意的是分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气。
本题难度:简单
4、选择题 某稀硫酸和稀硝酸的混合溶液200? mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6? g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.原混合酸中NO3-物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
参考答案:A
本题解析:试题分析:A、根据图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每份混合酸中n(NO3-)=n(Fe)=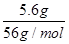 =0.1mol,所以原混合酸中NO3-物质的量为0.1? mol×2=0.2mol,故A不正确;B、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;D、反应最终消耗14.0g铁,物质的量=14.0g÷56g/mol=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.25mol,所以硫酸的浓度是0.25mol÷0.1L=2.5mol/l,故D正确,答案选A。
=0.1mol,所以原混合酸中NO3-物质的量为0.1? mol×2=0.2mol,故A不正确;B、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;D、反应最终消耗14.0g铁,物质的量=14.0g÷56g/mol=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸0.25mol,所以硫酸的浓度是0.25mol÷0.1L=2.5mol/l,故D正确,答案选A。
考点:考查金属铁与硝酸、硫酸反应的有关计算
本题难度:困难
5、实验题 某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O晶体。
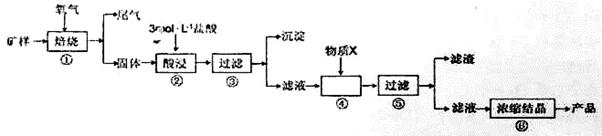
已知:常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
金属离子
| 氢氧化物开始沉淀的pH
| 氢氧化物沉淀完全的 pH
|
Fe2+
| 7.0
| 9.0
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
?
回答下列问题:
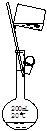
(1)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用右图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______、______

(2)培烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______、______
(3)步骤②酸浸过程中,需要用到3mol·L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_________
(4)步骤④加入物质X的目的是_____,物质X可以选用下列物质中的_____。
A.氢氧化钠?B.稀盐酸?C.氨水?D.氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol·L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]= _____。
参考答案:
(1)2H2O2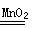 2H2O + O2 ↑,2Na2O2 + 2H2O =" 4NaOH" + O2 ↑。
2H2O + O2 ↑,2Na2O2 + 2H2O =" 4NaOH" + O2 ↑。
(2)2H2SO3+O2=2H2SO4,2(NH4)2SO3+O2=2(NH4)2SO4,2NH4HSO3+O2=2NH4HSO4
(3)100 mL容量瓶、量筒
(4)调控溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 ;? D
(5)1×10-15
本题解析:(1)该装置是固液不加热制气体的装置,可用该装置制备氧气的反应有H2O2和MnO2及Na2O2和H2O。
(2)尾气中含有SO2气体,通入氨水中后,SO2可与氨水反应生成(NH4)2SO3、NH4HSO3,SO32-易被氧化为SO42-。
(3)配制一定物质的量浓度盐酸溶液时,是将浓盐酸稀释为稀盐酸,因此还需要的玻璃仪器有容量瓶和量筒。
(4)步骤④加入X物质是为了调节溶液的pH,除去Fe3+。为防止引入杂质及Cu2+沉淀,应选用CuO。
(5)Fe2+完全沉淀时pH=9,则溶液中的c(OH-)=1×10-5mol·L-1,则Ksp=c(Fe2+)·c2(OH-)=1×10-5×(1×10-5)2=1×10-15。
本题难度:困难