|
高考化学知识点归纳《气体的净化、干燥、吸收与收集》高频试题预测(2017年最新版)(八)
2017-03-05 15:24:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)某同学用18 mol/L的浓硫酸配制200mL 0.9mol/L的稀硫酸,并进行有关实验。请回答下列问题:
(1)需要量取浓硫酸? ?mL(准确到小数点后一位)。
(2)配制该稀硫酸时使用的仪器除量筒、烧杯、200mL容量瓶外,还必须用到的仪器有? ?、? ?等。
(3)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是(? )
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上
D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响
| (4)在配制过程中,下列因素对所配制的稀硫酸的物质的量浓度有何影响?
若容量瓶未干燥即用来配制溶液,则所得溶液浓度? 0.9 mol·L-1(填“大于”、“等于”或“小于”,下同);若定容时俯视刻度线,则所得溶液浓度? 0.9 mol·L-1。
参考答案:(共10分) (1)10.0? (2分)
(2)玻璃棒?胶头滴管(可颠倒)。(每空1分)
(3)B(2分)?(4)等于?大于(每空2分)
本题解析:(1)在浓硫酸的稀释过程中,溶质是不变的,所以需要量取浓硫酸的体积是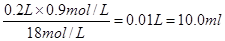 。 。
(2)稀释浓硫酸、向容量瓶中转移硫酸时都需要玻璃棒。另外定容时还需要胶头滴管。
(3)根据容量瓶的结构可知,瓶颈越粗,精确度越低,所以该建议不可取,答案选B。
(4)根据n=c·V可知,如果容量瓶没有干燥,则溶质的溶液的体积不受影响,浓度不变;如果定容时俯视刻度线,则所得溶液的体积偏少,浓度偏高。
点评:该题是高考中的常见题型,属于中等难度的试题。试题侧重考查学生的基础知识,兼顾能力的考查。该题的难度在于误差分析,配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
本题难度:一般
2、选择题 下列气体只能用排水法收集的是
A.NO
B.SO2
C.NH3
D.Cl2
参考答案:A
本题解析:NO极易被氧化生成NO2,只能用排水法收集,其余选项都可以用排空气法收集,答案选A。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固与训练,难度不大。该题的关键是记住常见气体的性质,然后灵活运用即可。
本题难度:简单
3、实验题 (I)电子工业常用30%的FeCl3。溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式?。
(2)检验溶液中Fe3+存在的试剂是?
(Ⅱ)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
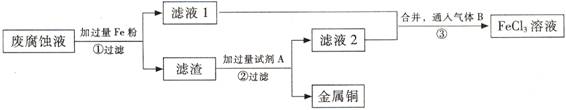 (3)?步骤①中发生反应的离子方程式? (3)?步骤①中发生反应的离子方程式?
(4)滤渣的主要成分是?,?(填化学式)。
(5)为了除去滤渣中的杂质得到铜,需加入的试剂A是?(填化学式)。
参考答案:(8分) (1)2FeCl3+Cu==2FeCl2+CuCl2? (2分)? (2)KSCN溶液(1分)
(3)2Fe3++Fe=3Fe2+? (1分)? Fe+Cu2+=Fe2++Cu? (1分)
(4)Cu、Fe? (2分)? (5)HCI?(1分)
本题解析:(1)FeCl3溶液做腐蚀液能与Cu反应生成CuCl2和FeCl2,反应的化学方程式是2FeCl3+Cu=2FeCl2+CuCl2。
(2)铁离子能和KSCN溶液反应,溶液显红色,所以检验溶液中Fe3+存在的试剂是KSCN溶液。
(3)铁离子、铜离子都能和铁反应,反应的离子方程式分别是2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu。
(4)由于铁是过量的,所以滤渣的主要成分是铁和铜。
(5)铁是活泼的金属,能和盐酸或稀硫酸反应。由于最终要得到氯化铁溶液,所以为了除去滤渣中的杂质得到铜,需加入的试剂A是盐酸而不是稀硫酸。
点评:该题是中等难度的试题,试题注重基础和能力的双向考查。试题综合性强,注重能力的训练,有利于培养学生的逻辑思维能力和规范的答题能力。
本题难度:一般
4、填空题 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是___?___________。

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质, 可用?溶液吸收多余的氯气,原理是(用化学方程式表示)_________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__?____(填化学式)
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继
发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是?。
A.NaOH
B.NaCl
C.KBr
D.Na2CO3
参考答案:(6分)(1)潮湿有色布条褪色而干燥有色布条不褪色?1分
(2)氢氧化钠(NaOH);1分;2NaOH+Cl2=NaClO+NaCl+H2O? 2分;Ca(ClO)2? 1分?(3)D? 1分
本题解析:(1)次氯酸具有漂白性,所以潮湿有色布条褪色而干燥有色布条不褪色。
(2)氯水显酸性,所以可以用氢氧化钠溶液吸收多余的氯气。反应的化学方程式是2NaOH+Cl2=NaClO+NaCl+H2O。漂白粉属于混合物,其有效成分是次氯酸钙。
(3)氢氧化钠具有腐蚀性,A不正确;氯化钠不能吸收氯气;溴化钾吸收氯气,又生成了单质溴,单质溴有毒,所以正确的答案选D。
点评:该题是中等难度的试题,试题注重基础,侧重考查学生的能力,有利于培养学生的逻辑思维能力和发散思维能力,也有助于培养学生的规范答题能力。该题的关键是熟练记住常见物质的化学性质。
本题难度:一般
5、选择题 下列气体中,既能用浓硫酸干燥又能用碱石灰干燥的是( )
A.O2
B.SO2
C.NH3
D.Cl2
参考答案:A、氧气为中性气体,既能用浓硫酸干燥又能用碱石灰干燥,故A正确;
B、二氧化硫为酸性氧化物,能够与碱石灰反应,不能使用碱石灰干燥,故B错误;
C、氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D、氯气能够与碱石灰反应,不能使用碱石灰干燥,故D错误;
故选A.
本题解析:
本题难度:一般
|