微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
参考答案:Ⅰ.(1)H2O NH3 NH4+ OH-
(2)Al3++3NH3+3H2O=Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+
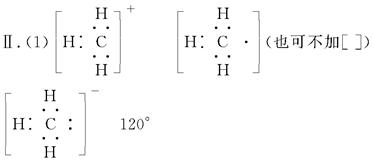
(2)CO2 N2O BeF2
本题解析:Ⅰ.以Ne为基本出发点,依题意找出等电子微粒解答。
Ⅱ.(1)由电子式书写规则写出电子式,(2)利用等电子原理找出符合题意的物质。
本题难度:一般
2、填空题 已知N、P同属于元素周期表的第VA族元素,N在第2周期,P在第3周期。NH3
分子呈三角锥形,氮原子位于锥顶,三个氢原子位于锥底,N—H键间的夹角是107°。
(1)PH3分子与NH3分子的构型关系是________(填“相同”或“相似”或“不相似”),P—H______极
性(填“有”或“无”),PH3分子________极性(填“有”或“无”)。
(2)NH3与PH3相比,热稳定性________(填化学式)更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是________.
A.键的极性N—H比P—H强
B.分子的极性NH3比PH3强
C.相对分子质量PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力
参考答案:(1)相似 有 有? (2)NH3 (3)D
本题解析:(1)N和P都是第ⅤA族元素,其氢化物的结构是相似,所以pH3分子与NH3分子的构型关系是相似的。分子中的共价键均是极性键。
(2)氮元素的非金属性强于P元素的,则氨气的稳定性强于pH3的。
(3)由于氮元素是活泼的非金属元素,在氨气分子间存在氢键,所以氨气比pH3易液化,答案选D。
点评:该题主要是第ⅤA族中第N和P的氢化物为载体,重点考查学生运用物质结构理论解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,有助于激发学生的学习兴趣和学习积极性。
本题难度:简单
3、填空题 (15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
元素
| 相关信息
|
X
| 基态原子最外层电子排布为nsnnpn+1
|
Y
| 其原子L层电子数是K层3倍
|
Z
| 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同
|
W
| 其单质在Y2中燃烧,发出明亮的蓝紫色火焰
|
T
| 其最高正价与最低负价的代数和为6
|
?
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是?(用离子符号表示);T元素的基态原子核外电子排布式为?。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有?,晶体类型为?。
(3)T元素的最高价氧化物对应水化物的化学式是?H2Y的沸点比H2W高的原因是?。
(4) Z2 WY3溶液呈?性,其原因是(用离子方程式表示)?。
(5)已知25℃、101 kPa下:
①2Z(s)+  ?Y2(s)=Z2Y(s)?△H1=-414KJ/mol
?Y2(s)=Z2Y(s)?△H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s)?△H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为?。
参考答案:(1)Na+<O2-<S2-;1s22s22p63s23p5或【Ne】3s23p5;(2)离子键、共价键;离子晶体;(3)HClO4,水分子间易形成氢键;(4)碱,SO32-+H2O HSO3-+OH-,HSO3-+H2O
HSO3-+OH-,HSO3-+H2O H2SO3+OH-;
H2SO3+OH-;
(5)Na2O2(s)+2Na(s)=2Na2O(s)?H= -317KJ/mol
本题解析:根据题意可知:X是N;Y是O;Z是Na;W是S;T是Cl。(1)Na+、O2-的核外电子排布是2、8;而S2-的核外电子排布是2、8、8.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,对于电子层结构不同的微粒来说,电子层数越多,离子半径就越大。故离子半径由小到大的顺序是Na+<O2-<S2-;17号元素Cl元素的基态原子核外电子排布式为1s22s22p63s23p5或【Ne】3s23p5;(2)N与Na两元素可形成化合物NaN3,其晶体中化学键类型有离子键、共价键;其晶体类型为离子晶体;(3)Cl元素的最高价氧化物对应水化物的化学式是HClO4,H2O的沸点比H2S高是因为在水的分子之间存在氢键,增加了分子之间的相互作用。(4) Na2SO3是强碱弱酸盐,水解使溶液呈碱性。水解的两种方程式是SO32-+H2O HSO3-+OH-,HSO3-+H2O
HSO3-+OH-,HSO3-+H2O H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s)?H= -317KJ/mol。
H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s)?H= -317KJ/mol。
本题难度:一般
4、选择题 两种微粒的质子数和电子数均分别相等,它们不可能是
A.一种阳离子和一种阴离子
B.一种单质和一种化合物分子
C.一种分子和一种离子
D.一种原子和一种分子
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列有关物质的分类或归类正确的是
A.混合物:石炭酸、水玻璃、水银
B.化合物:乙醇、漂白粉、HD
C.电解质:明矾、冰醋酸、硫酸钡
D.同系物:CH2O2、C2H4O2、C3H6O2
参考答案:C
本题解析:
本题难度:一般