? A? Mg,0.1? 6 mol·L-1硝酸10mL? 80
B? Mg,0.1? 3 mol·L-1盐酸10mL? 60
C? Fe,0.1? 3 mol·L-1L 盐酸10mL? 60
D? Mg,0.1? 3 mol·L-1硫酸10mL? 60
参考答案:D
本题解析:考查外界条件对反应速率的影响。再其它体积不变的情况下,增大反应物浓度,或升高温度,或使用催化剂、或增大反应物的接触面积等均可以即可反应速率。由于硝酸是氧化性酸,和金属反应得不到氢气。镁的活泼性其余铁,所以正确的答案选D。
本题难度:简单
3、实验题 (18分)某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
实验编号
| 实验操作
| 实验现象
| ①
| 取少量黑色粉末X放入试管1中,注入浓盐酸,微热
| 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生
| ②
| 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置
| 有极少量红色物质析出,仍有较多黑色固体未溶解
|
由上述实验现象推断,黑色粉末X的成分是?。
II定量测定

⑴操作Z的名称是?。
下列仪器中,在灼烧沉淀时必须用到的是?(填字母)。
 ? ?  
A? B? C? D? E? F
⑵写出溶液Y中滴加H2O2溶液时发生反应的离子方程式?。
⑶将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2 = 0.3g,则接下来还应进行的操作是
? ?。 ?。
⑷有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是?。(用化学方程式表示)
⑸通过以上数据,得出2.376g黑色粉末中各成分的物质的量为?。
参考答案:除(5)是4分, 方程式各3分,其他每空2分
Ⅰ? Fe 、 Fe3O4(2分)
Ⅱ(1)过滤、洗涤 (只选过滤得1分)?A C E F(2分)
(2)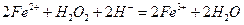 (3分) (3分)
(3)再次加热 并置于干燥器中冷却,称量,直至两次的质量差不超过0.1g为止。(2分) 并置于干燥器中冷却,称量,直至两次的质量差不超过0.1g为止。(2分)
(4)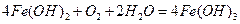 (3分) (3分)
(5)n(Fe)=0.001mol(2分)? n(Fe3O4)=0.01mol(2分)
本题解析:略
本题难度:一般
4、实验题 (15分)某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是?。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:?。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是?。用离子方程式解释产生气泡的原因:?。
⑶放出的气体是?,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是?。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是?。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
选项
| 铝电极
| 电解质
| 负极反应
| 正极反应
| A
| 正极
| NaOH
| Al-3e-=Al3+
| 2H2O+2e-=2OH-+H2↑
| B
| 负极
| 稀盐酸
| 2Al-6e-=2Al3+
| 6H++6e-=3H2↑
| C
| 正极
| 浓硝酸
| Cu-2e--=Cu2+
| 2NO3-+4H+-4e-=2NO2↑+2H2O
| D
| 负极
| 稀硝酸
| Cu-2e-=Cu2+
| 2NO3-+8H+=2NO↑+4H2O+6e-
|
其中正确的是?,由此推知,金属作电极不仅与本身性质相关,而且与 ________?有关。
参考答案:(15分)⑴C (1分)在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意:不能加入盐酸),若反应明显加快了,说明上述推断正确。(2分)
⑵2Al+3Cu2+=3Cu+2Al3+;(2分)Al3++3H2O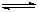 Al(OH)3+3H+,Cu2++2H2O Al(OH)3+3H+,Cu2++2H2O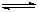 Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑?(2分) Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑?(2分)
(3)氢气(1分)? ①随着反应进行生成铝离子浓度增大,水解程度增大,产生大量H+? ②该反应放热,升高温度反应加快? ③铜与铝构成原电池,加快铝失电子?(3分)
⑷AB?(2分)
⑸B( 2分)?电解质的性质(1分) 2分)?电解质的性质(1分)
本题解析:略
本题难度:一般
5、实验题
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
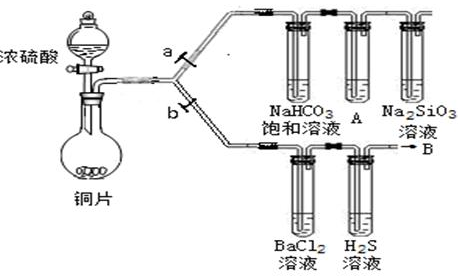
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
参考答案:(1)② Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O KMnO4溶液 CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
?
BaSO4
BaSO3
?
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
本题解析:(注:本题下载后无题文部分)
(1)② Cu + 2H2SO4(浓)  CuSO4 + SO2↑+ 2H2O KMnO4溶液 CuSO4 + SO2↑+ 2H2O KMnO4溶液
③A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀
(2)②2H2S + SO2 =" 3S↓" + 2H2O
③
?
BaSO4
BaSO3
?
Ba2+ + SO2 + Cl2 + 2H2O ="=" BaSO4↓+ 4H+ + 2Cl—
④0.56g 224mL ≤ V ≤ 448mL
CO2通入KOH和Ca(OH)2的混合溶液中,第一步反应为
Ca(OH)2+CO2 CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2 CaCO3↓+H2O,Ca(OH)2恰好反应完时沉淀质量最大,此时可由0.01 mol CO2来算Ca(OH)2和CaCO3的物质的量为0.01 mol。第二步反应为KOH+CO2 KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O KHCO3,KOH的质量为(1.3-0.01×74)g="0.56" g,所以n(KOH)="0.01" mol,第二步消耗的CO2也为0.01 mol ,第三步CaCO3+CO2+H2O Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。 Ca(HCO3)2,又消耗0.01 mol CO2。最后一问上面第二步反应沉淀最大且质量不变,消耗CO2的值为0.01mol―0.02mol之间,体积为224mL ≤ V ≤ 448mL。
本题难度:一般
|