微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 看右上图回答下列问题
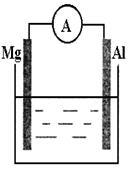
(1)若烧杯中溶液为稀硫酸,则观察到的现象是
,电流表指针 (填偏转或不偏转),
两极反应式为:
正极 ;
负极 。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为 (填Mg或Al),总反应方程式为
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右下图所示:A、B两个电极均由多孔的碳块组成。
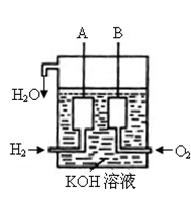
该电池的正极反应式为: 。
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,
则该电池的负极反应式为: 。
参考答案:(1)镁逐渐溶解,铝上有气泡冒出 (1分) ,偏转(1分)
正极 2H++2e=H2 (2分)
负极 Mg —2 e-= Mg2+ (2分)
(2) Al (1分)
2Al +2 NaOH+2H2O = 2NaAlO2 +3H2(2分)
(3)O2+2H2O+4e-=4OH-(2分)
(4)CH4+10OH-—8e-=CO32-+7H2O (2分)
本题解析:略
本题难度:一般
2、选择题 下列有关化学实验表现的内容错误的是( )
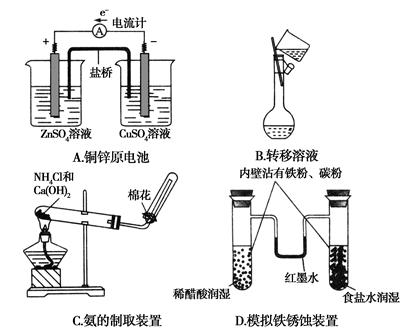
参考答案:A
本题解析:由A项两烧杯中的溶液可推知:盛放硫酸锌溶液的烧杯中的电极应为锌棒,盛放硫酸铜溶液的烧杯中的电极应为铜棒。由原电池原理判断:锌棒应为负极,铜棒应为正极,故A不正确。
本题难度:一般
3、填空题 (10分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从
经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极),放电一段时间后,正极区pH值 (填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表。
负极电极反应式为_________________,
总反应的离子方程式为______ 。
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,也有电流通过电流表,请写出负极电极反应式____________,正极电极反应式为_____________。
参考答案:(1)2H++2e-=H2↑ 还原 锌 铜 正极 变大
(2) Fe-2e-= Fe2+ Fe+2Fe3+=3Fe2+
(3)负极:2Fe-4e-=2Fe2+ 正极: O2+4e-+2H2O=4OH-
本题解析:(1)在原电池中较活泼的金属作负极,失去电子被氧化,发生氧化反应。电子经过导线传递到正极是,所以溶液中的阳离子向正极移动,在正极得到电子,发生还原反应。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,此时铁是负极,失去电子被氧化而溶解。铜是正极,溶液中的铁离子得到电子,被还原生成亚铁离子。
(3) 将铁片和石墨电极用导线连接后插入氯化钠溶液并露置在空气中,此时将发生铁的吸氧腐蚀,铁作负极。石墨作正极,溶解在溶液中的氧气得到电子。
本题难度:一般
4、选择题 关于下列各装置图的叙述中,不正确的是( )
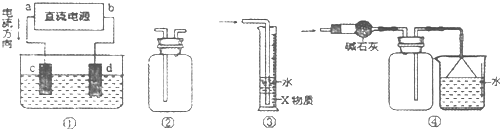
A.装置①中,c为阳极,d为阴极
B.装置②可用于排空气法收集H2、NH3、Cl2、HCl、NO等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
参考答案:A.电流由正极流向负极,则a为正极,所以c为阳极,d与负极相连为阴极,故A正确;
B.NO易与氧气反应,不能利用排空气法收集,置②可用于排空气法收集H2、NH3、Cl2、HCl,故B错误;
C.四氯化碳在下层,可起防止倒吸的作用,则装置③可用于吸收氨气或氯化氢,故C正确;
D.碱石灰干燥氨气,向下排空气收集氨气,倒扣的漏斗起防止倒吸的作用,则装置④可用于干燥、收集氨气,并吸收多余的氨气,故D正确;
故选B.
本题解析:
本题难度:一般
5、填空题 对于锌、铜和稀硫酸组成的原电池。Zn是 ① 极(填正或负),发生的反应类型为 ② (填氧化或还原)反应, ③ 片(填锌、铜)上有气泡产生,该气体是 ④ (填氢气、氧气) , 电子由⑤ 片通过导线流向 ⑥ 片(填锌、铜),溶液中的H+移向 ⑦ 极(填正或负),溶液中的H+浓度 ⑧ ,(填增大、不变或减小 ),该装置能将 ⑨ 能转变为 ⑩ 能。
参考答案:负;氧化;铜;氢气;锌;铜;正;减小;化学;电
本题解析:考查原电池的概念及有关判断。在原电池中较活泼的金属作负极失去电子,被氧化,发生氧化反应。不活泼的金属作正极,负极所失去的电子经导线传递到正极上,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极。
本题难度:一般