微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置能够组成原电池的是( )
A.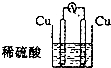
B.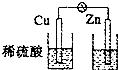
C.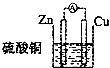
D.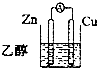
参考答案:A.两个电极材料相同,Cu与稀硫酸不反应,不能组成原电池,故A错误;
B.不能形成闭合回路,不能组成原电池,故B错误;
C.符合原电池的构成条件,发生Zn+CuSO4=ZnSO4+Cu的电池反应,故C正确;
D.乙醇为非电解质,不导电,不能组成原电池,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
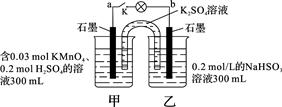
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
参考答案:C
本题解析:A.n(e-)=1.204×1022÷6.02×1023=0.02mol.则在乙烧杯中发生反应的NaHSO3的物质的量为0.01mol。产生的H+的物质的量为0.01mol。c(H+)=0.01mol÷0.1L=0.1mol/L。溶液中的H+主要是由NaHSO3反应产生。所以pH=1正确。B.在该原电池反应中,乙池的石墨电极为负极,甲池的石墨电极为正极。根据同种电荷相互排斥,异种电荷相互吸引的原则,电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a。正确。C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,溶液中的c(H+)不断减小,所以由水电离出的c(H+)逐渐增大。错误。D.在乙池中HSO3-不断被氧化,变为SO42-。因此该烧杯的氧化产物为SO42-。
本题难度:一般
3、选择题 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确是
A.阳极反应为Fe-2e- =Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
参考答案:B
本题解析:A、铁为活泼电极,铁板作阳极时电解过程中电极本身失电子,电极反应式为: Fe-2e-=Fe2+,正确;B、根据题意知,反应过程中溶液中的氢离子浓度减小,溶液pH增大,错误;C、根据Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O知,反应过程中消耗了大量H+,使得Cr3+和Fe3+都转化为氢氧化物沉淀,正确;D、电路中每转移12?mol电子,有6mol Fe2+,结合题给反应知最多有1?mol?Cr2O72-被还原,正确。
本题难度:一般
4、填空题 依据氧化还原反应:2Ag+(aq)+Fe(s)?=Fe2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题

(1)电极X的材料是________;电解质溶液Y是__________;
(2)银电极为电池的__________极;X电极上发生的电极反应为___________;
(3)盐桥中的阳离子移动的方向是________(移向X或移向Y)。
参考答案:(1)Fe;AgNO3 ?
(2)正;Fe-2e-=Fe2+?
(3)移向Y
本题解析:
本题难度:一般
5、填空题 (8分)如图所示的原电池中,回答下列问题
(1)负极材料
(2)写出电极反应式:正极: ;负极: 。
(3)写出电极反应总反应式
(4)电子由 极流向 极(填写Zn或Cu)
参考答案:(1)Zn (2分) (2)2H++2e-=H2 (1分) Zn-2e-=Zn2+ (1分)
Zn+2H+=Zn2++H2 (2分) (4)Zn Cu (2分)
本题解析:考查原电池的有关判断和应用。在原电池中较活泼的金属作负极,失去电子,发生氧化反应,所失去的电子经导线传递到正极上。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,发生还原反应生成氢气。
本题难度:一般