微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
2NH3(g)+CO2(g),已知15℃时,平衡气体总浓度为2.4×10-3mol/L,下列说法中正确的是
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.15℃时氨基甲酸铵的分解平衡常数为2.048×10-9(mol/L)3
C.恒温下压缩体积,NH3的体积分数减小
D.再加入一定量氨基甲酸铵,可加快反应速率
参考答案:B
本题解析:A、反应物为固体,生成物全部为气体,从反应开始到平衡状态,气体的平均相对分子质量始终是(2×17+44)/3=26,错误;B、15℃时,平衡气体总浓度为2.4×10-3mol/L,则平衡时氨气浓度是1.6×10-3mol/L,二氧化碳浓度是0.8×10-3 mol/L,K=c2(NH3)c(CO2)=2.048×10-9(mol/L)3,正确;C、恒温下压缩体积,压强增大,平衡虽然逆向移动,但NH3与CO2的物质的量比始终是2:1,所以NH3的体积分数不变,正确;D、氨基甲酸铵是固体,再加入一定量氨基甲酸铵,对反应速率无影响,错误,
答案选B。
本题难度:一般
2、选择题 某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
参考答案:B
本题解析:A、W是固体,用量增加不能增大其浓度,速率不变,错误;B、正反应是气体物质的量减小的方向,混合气体的压强减小至不变时,说明已达平衡,正确;C、ΔH>0,则正反应是吸热反应,升高温度平衡正向移动,错误;D、增大c(X),平衡正向移动,但焓变不变,错误。
本题难度:一般
3、选择题 在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)  W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
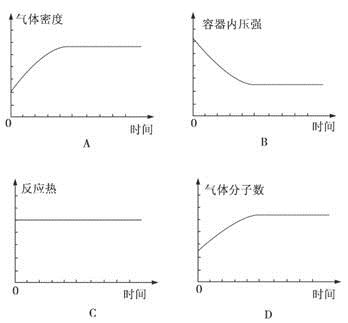
参考答案:D
本题解析:A项,W的状态不确定,若W为固态或液态,气体密度应逐渐变小至不变,图像错误;若W为气态,则气体密度始终不变,图像错误。B项,无论W是不是气体,容器内压强都应增大至不变;C项,反应热只与具体反应中各物质的化学计量数有关,与是否达到平衡无关;D项,无论W是不是气体,产物的气体分子数都逐渐增大,当气体分子数不变时,表明达到平衡状态,D项正确。
本题难度:一般
4、选择题 X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
[? ]
A.33%
B.40%
C.50%
D.65%
参考答案:D
本题解析:
本题难度:一般
5、填空题 2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应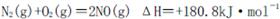 是导致汽车尾?气中含有NO的重要原因之一。
是导致汽车尾?气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行?(填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为
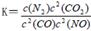 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
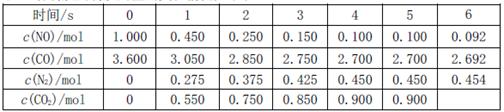
①根据土表数据计算0~4s间用NO表示的平均速率v(NO)=?;达到化学平衡时两种反应物的转化率是否相等?(填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率?(填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是?。
A.选用更有效的催化剂? B.缩小容器的体积
C.降低CO2浓度?D.升高温度?
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下
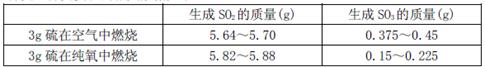
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3?(填“多”或“少”),原因可能是?。
A.纯氧中氧气浓度高,有利于化学平衡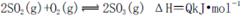 向右移动
向右移动
B.化学反应
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡
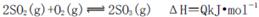 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡
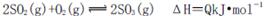 向右移动
向右移动
参考答案:(14分)
能?(2分)
①0.0225mol·L-1·s-1(2分);不相等(2分)
②减小(2分)
③BC(2分)
(3)少(2分);BC(2分)
本题解析:
(1)该反应是放热反应,能自发进行。
(2)①v(NO)=△c/△t=0.0225mol·L-1·s-1;两物质的起始量不同,转化量相同,所以转化率不同。
②该反应是放热反应,只有温度下降才能使K增大,温度下降v减小。
③分析数据,平衡应该正向移动,A.使用催化剂不改变平衡,错误;D.升高温度,K改变,错误。
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3少,用BC项内容可以解释。
本题难度:一般