微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (5分)Na2CO3、NaHCO3、NaCl的固体混合物共4.0 g,把它们加强热到质量不再减轻,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生CO20.88 g。回答
(1)原混合物中NaHCO3的质量是多少克?(2)原混合物中含NaCl多少克?
参考答案:(5分)(1)1.68? g (2)1.26g
本题解析:(1)碳酸氢钠分解的化学方程式是
2NaHCO3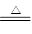 Na2CO3+H2O+CO2↑?△m↓
Na2CO3+H2O+CO2↑?△m↓
168g? 106g? 62g
x? y? 4.0g-3.38g=0.62g
所以x=1.68g、y=1.06g
(2)碳酸钠和盐酸反应的化学方程式是
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106g? 44g
2.12g? 88g
其中由碳酸氢钠分解生成的碳酸钠是1.06g
所以原混合物中碳酸钠的质量是2.12g-1.06g=1.06g
因此氯化钠的质量是4.0g-1.68g-1.06g=1.26g
点评:该题是中等难度的试题,试题基础性强,难易适中。该题的解题思路是借助于差量法,因此关键是准确写出反应的化学方程式,找出关系式,列式计算即可。该题有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
2、填空题 我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下:
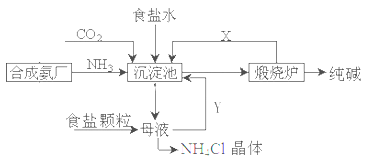
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉: ?
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。
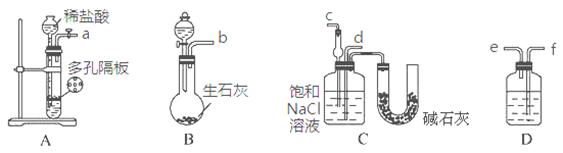
(3)上述装置中接口连接顺序为?;
A.a接c;b接f、e接d? B.a接d;b接f、e接c
C.b接d;a接e、f接c?D.b接c;a接f、e接d
(4)D中应选用的液体为?。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 ? 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
参考答案:(1)2NaHCO3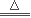 Na2CO3+CO2↑+H2O?(3分)
Na2CO3+CO2↑+H2O?(3分)
(2)C (2分)?(3)D (3分)
(4)饱和NaHCO3溶液 (2分)?(5)稀HNO3和AgNO3溶液(2分)
(6)84c(V2- V1)∕1000W (3分)
本题解析:(1)煅烧炉中主要是把沉淀池中得到的NaHCO3加热使之分解得到碳酸钠,方程式为2NaHCO3 Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
Na2CO3+CO2↑+H2O;(2)联合制碱法的生产原料为:食盐、NH3、CO2,A正确;副产物氯化铵可做氮肥,正确;生产过程中可循环利用的物质除CO2外,还有NaCl,错误;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,正确。(3)“联合制碱法”的第一步反应为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,故模拟装置中接口连接顺序为b接c;a接f、e接d;(4)D装置的作用是除去CO2中混有的HCl,可选用饱和NaHCO3溶液;(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加稀HNO3和AgNO3溶液;(6)根据所给信息可知,样品中NaHCO3的物质的量为c(V2-V1)/1000 mol,故纯碱样品中NaHCO3质量分数为84c(V2- V1)∕1000W。
本题难度:一般
3、实验题 (16分)某小组的同学对放置已久的过氧化钠的成份进行探究,请回答下列问题:
(1)反应 2Na2O2+2H2O=4NaOH+O2↑的还原剂是?(写化学式);
反应2Na2O2+2CO2=2Na2CO3+O2↑中,每生成1molO2则转移了?mol电子。
(2)进行探究:
①提出假设。假设1:全部是Na2O2?假设2:全部是Na2CO3
假设3:?
②设计方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、1moL L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
实验步骤
| 预期现象和结论
|
步骤1:取少量固体样品于试管中,滴加足量1moL L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。 L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。
| 若澄清石灰水未见浑浊,则假设1成立;
若澄清石灰水变浑浊,则?
?
|
步骤2:
| ?
|
步骤3:
| ?
参考答案:(16分)(1)(4分)Na2O2? 2
(2)①(2分)假设3:是Na2O2与Na2CO3的混合物 [说明:不可能有NaOH,因为在空气中即使吸水生成有NaOH,但时间长了也与CO2反应生成了Na2CO3]
②
实验步骤
预期现象和结论
?
假设2或假设3成立(2分,或假设1不成立)
步骤2:另取少量固体于试管中加适量蒸馏水(2分),再滴入酚酞溶液(2分)[或,用带火星的火柴伸入试管口] [如果向步骤一的溶液中直接滴酚酞,或用KI淀粉液,扣1分]
若滴入酚酞溶液后先变红后褪色(或溶液变蓝色,2分)[或带火星的火柴复燃],则假设1或假设3成立(1分);若红色不褪色,则假设2成立(1分)
本题解析:(1)反应中的电子转移为: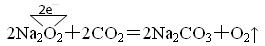 ,是Na2O2发生了自身氧化还原反应,既是氧化剂又是还原剂,每生成每生成1molO2则转移了2mol电子 ,是Na2O2发生了自身氧化还原反应,既是氧化剂又是还原剂,每生成每生成1molO2则转移了2mol电子
(2)①Na2O2在空气中主要是可以和CO2、H2O反应分别生成Na2CO3与NaOH,而因为NaOH在空气中与CO2反应最终也生成Na2CO3,所以不可能有NaOH,故有三种假设情况
②实际上就是CO32—及Na2O2的检验。
本题难度:一般
4、选择题 下列类比关系正确的是
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
参考答案:D
本题解析:A、Li与氧气反应只生成Li2O;B、Na2O2与SO2反应生成Na2SO4;C、Fe与I2反应生成FeI2;D正确。
本题难度:一般
5、选择题 下列物质不能使红墨水褪色的是( )
A.活性炭
B.过氧化钠
C.NaCl溶液
D.漂白粉
参考答案:C
本题解析:A.活性炭有吸附作用,所以能够使红墨水褪色,错误;B.过氧化钠能够与水反应产生过氧化氢,有强的氧化性,所以能够使红墨水褪色,错误;C.NaCl溶液无漂白性,不能使红墨水褪色;正确;D.漂白粉与水混合会产生有漂白性的HClO,能够使红墨水褪色,错误。
本题难度:简单
|