微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请配平化学方程式,用双线桥标出电子转移的方向与数目。
□KI+□KIO3+□H2SO4——□I2+□K2SO4+□H2O
此反应中,氧化剂是?,还原剂是?。
参考答案:(6分)配平化学方程式,用双线桥标出电子转移的方向与数目。
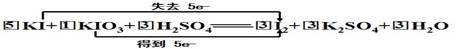
氧化剂: KIO3?还原剂:? KI?配平2分?双线桥2分?填空各1分
本题解析:KI中碘元素从-1价变为0价,失去一个电子,为还原剂;KIO3中碘元素从+5价变为0价,得到5个电子,为氧化剂,根据得失电子数相等,KI系数为5,KIO3系数为1,I2系数为3,最后根据钾元素和氢元素守恒,配平
本题难度:一般
2、选择题 2010年10月1日下午18时59分57秒,中国探月工程先导星“嫦娥二号”在西昌点火升空,准确入轨。月球上有着非常丰富的钛铁矿(主要成分是FeTiO3)资源。已知钛铁矿与氢气在1 000 ℃条件下发生如下反应:FeTiO3+H2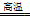 Fe+TiO2+H2O,下列有关该反应的说法错误的是( )
Fe+TiO2+H2O,下列有关该反应的说法错误的是( )
A.FeTiO3中Fe显+2价,Ti显+4价
B.TiO2既不是氧化产物也不是还原产物
C.反应中生成1 mol铁将转移3 mol电子
D.FeTiO3在反应中作氧化剂
参考答案:C
本题解析:
试卷分析:根据反应FeTiO3+H2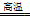 Fe+TiO2+H2O可知,FeTiO3中的Fe为+2价Ti显+4价,反应前后Ti的化合价没有变化,所以TiO2既不是氧化产物也不是还原产物。反应中Fe的化合价由+2价变为0价,生成1 mol铁将转移2mol电子且FeTiO3在反应中作氧化剂。答案选C。
Fe+TiO2+H2O可知,FeTiO3中的Fe为+2价Ti显+4价,反应前后Ti的化合价没有变化,所以TiO2既不是氧化产物也不是还原产物。反应中Fe的化合价由+2价变为0价,生成1 mol铁将转移2mol电子且FeTiO3在反应中作氧化剂。答案选C。
点评:本题主要考查的是氧化还原反应的基本概念,难度小,基础性强。
本题难度:一般
3、实验题 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是??。
第1组
| 第2组
| 第3组
|
S (单质)
| SO2、H2SO3、M、NaHSO3
| SO3、H2SO4、Na2SO4、 NaHSO4
|
?
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
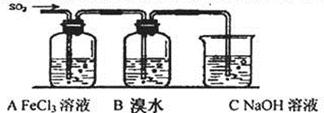
(1)下列实验方案可以用于在实验室制取所需SO2的是??。
A.Na2SO3溶液与HNO3?B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧?D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
n(SO32—):n(HSO3—)
| 91:9
| 1:1
| 9:91
|
pH
| 8.2
| 7.2
| 6.2
|
?
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是??。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
序号
| 实验方案
| 实验现象
| 结论
|
方案①
| 往第一份试液中加入KMnO4溶液溶液
| 紫红色褪去
| SO2与Fe3+反应生成了Fe2+
|
方案②
| 往第二份试液中加入
| ?
| SO2与Fe3+反应生成了Fe2+
|
方案③
| 往第二份试液中加入
| ?
| SO2与Fe3+反应生成了SO42—
|
?
上述方案①得出的结论是否合理?,原因??。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是??。
参考答案:(15分)
Ⅰ.Na2SO3(2分)
Ⅱ. (1)BD(2分)? (2) AC?(2分)
(3)否?(1分) SO2、Fe2+都能使酸性高锰酸钾溶液褪色(2分)
方案②:往第二份试液加入KSCN溶液,观察现象,再加入新制的氯水,(1分)先不变红,后溶液变红。(1分)
方案③:往第三份试液加入稀盐酸酸化,再加入BaCl2溶液(1分) 产生白色沉淀。(1分)
(4)B 中橙色(或黄色)褪去(2分)
本题解析:
Ⅰ.第2组中硫元素都为+4价。
Ⅱ.(1)A、HNO3有挥发性,错误; B、可行;C、该方法不适合实验室使用,错误;D、可行
(2)A、符合电荷守恒,正确;B、C比较,当比值为10:1是,溶液呈碱性,说明SO32-浓度比 HSO3-大。
(3)SO2如果和Fe3+发生氧化还原产物为SO42-和Fe2+,因此需要检验这两个离子。
方案①不合理,SO2也能让高锰酸钾褪色。
(4)B 中橙色(或黄色)褪去,说明还原性小于SO2
本题难度:一般
4、选择题 下列反应既是氧化还原反应又是离子反应的是
[? ]
A.钠在氯气中燃烧
B.二氧化碳通入澄清的石灰水中
C.氯化钠溶液中滴加硝酸银溶液
D.锌粒放入稀硫酸中
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列化工生产过程中所发生的反应不属于氧化还原反应的是
[? ]
A.用大理石制生石灰
B.用铝土矿制金属铝
C.用氯气和消石灰制漂白粉
D.用氢气和氮气合成氨
参考答案:A
本题解析:
试题分析:
选项A,用大理石制生石灰是分解反应,化合价不变,非氧化还原反应;
选项B,用铝土矿制金属铝,化合价改变是氧化还原反应;
选项C,用氯气和消石灰制漂白粉,化合价变化是氧化还原反应;
选项D,用氢气和氮气合成氨,化合价改变是氧化还原反应。
故选:A
本题难度:简单