|
高中化学知识点总结《化学平衡》考点巩固(2017年最新版)(八)
2017-03-05 15:34:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述相符的是
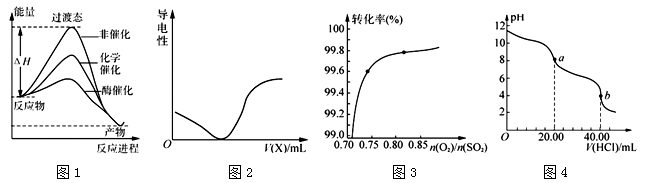
A.由图1所示曲线可知,化学催化比酶催化的效果好
B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O
|
参考答案:D
本题解析:A.由图1所示曲线可知,化学催化物质反应的活化能大于酶催化的活化能,所以酶催化比化学催化的效果好,错误;B.在H2S溶液导电性实验中,由图2所示曲线可加入的物质与H2S反应产生的物质溶解度小,使溶液中离子的浓度降低,当二者恰好完全反应时离子浓度几乎为0,后当加入的物质过量时,该物质电离产生大量的自由移动的离子,是溶液的导电性增强,则通入的气体X可能为SO2,错误;C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,在其它条件不变时氧气越多,SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.盐酸与Na2CO3的反应是分步进行的,首先发生反应: CO32-+H+= HCO3-,然后发生反应:HCO3-+H+= CO2↑+H2O。图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。 2SO3(g)转化关系(图3)中,在其它条件不变时氧气越多,SO2的转化率就越大,所以纵坐标表示SO2的转化率,错误;D.盐酸与Na2CO3的反应是分步进行的,首先发生反应: CO32-+H+= HCO3-,然后发生反应:HCO3-+H+= CO2↑+H2O。图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+= CO2↑+H2O,正确。
考点:考查图像法在物质的反应、导电性、物质的转化率的表示的应用的知识。
本题难度:困难
2、选择题 下列平衡体系在体积不变时加入所给物质,平衡移动的是
[? ]
A.FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体
B.N2(g)+3H2(g)  2NH3(g),加入HCl 2NH3(g),加入HCl
C.CaCO3(s) CaO(s)+CO2(g),加入CaCO3 CaO(s)+CO2(g),加入CaCO3
D.2SO2(g)+O2(g)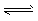 2SO3(g),加入N2 2SO3(g),加入N2
参考答案:B
本题解析:
本题难度:一般
3、填空题 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)请回答下列问题: W (s) + 3H2O (g)请回答下列问题:
(1)上述反应的化学平衡常数表达式为 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为3:5,则H2的平衡转化率 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度
| 25℃ ~ 550℃ ~ 600℃ ~ 700℃
| 主要成份
| WO3 W2O5 WO2 W
|
500℃时,固体物质的主要成分为 ;
第二阶段反应的化学方程式为 ;
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 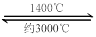 WI4 (g)。下列说法正确的有 。 WI4 (g)。下列说法正确的有 。
A.灯管内的I2可循环使用
B.WI4在灯管壁上分解,使灯管的寿命延长
C.WI4在灯丝上分解,产生的W又沉积在灯丝上
D.接通电源后,WI4的分解速率加快,W和I2的化合速率减慢
参考答案:(1)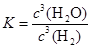
(2)62.5%
(3)WO3、W2O5 W2O5+H2 2WO2+H2O 1∶1∶4 2WO2+H2O 1∶1∶4
(4)A、C
本题解析:(1)化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。对该反应来说,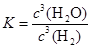 。(2)根据反应方程式可知每产生3mol的H2O,则消耗3mol的H2。若某温度下反应达平衡时,H2与水蒸气的体积比为3:5,消耗的H2是5mol.所以H2的平衡转化率为5÷(5+3)×100%=62.5%。(3)根据表格中的物质与温度的关系可知:在500℃时,固体物质的主要成分为WO3、W2O5。在在第一个阶段发生的反应为:2WO3 (s) +H2 (g) 。(2)根据反应方程式可知每产生3mol的H2O,则消耗3mol的H2。若某温度下反应达平衡时,H2与水蒸气的体积比为3:5,消耗的H2是5mol.所以H2的平衡转化率为5÷(5+3)×100%=62.5%。(3)根据表格中的物质与温度的关系可知:在500℃时,固体物质的主要成分为WO3、W2O5。在在第一个阶段发生的反应为:2WO3 (s) +H2 (g)  W2O5 (s) + H2O (g);在第二阶段反应的化学方程式为W2O5+H2 W2O5 (s) + H2O (g);在第二阶段反应的化学方程式为W2O5+H2 2WO2+H2O;在第三个阶段发生的反应为WO2+2H2 2WO2+H2O;在第三个阶段发生的反应为WO2+2H2 2W+2H2O。若WO3完全转化为W,假设开始有2mol的WO3,则在三个阶段消耗H2物质的量之比为1:1:4。(4)A.在1400℃左右,平衡正向移动;在约3000℃左右,平衡逆向移动。因此在灯管内的I2可循环使用。正确。B.WI4在灯管壁上分解,减少生成物的浓度,平衡正向移动,使灯管的寿命缩短。错误。C.WI4在灯丝上分解,分解产生的W及I2又沉积在灯丝上。正确。D.接通电源后,电能转化为热能,WI4的分解速率加快,W和I2的化合速率也加快。错误。 2W+2H2O。若WO3完全转化为W,假设开始有2mol的WO3,则在三个阶段消耗H2物质的量之比为1:1:4。(4)A.在1400℃左右,平衡正向移动;在约3000℃左右,平衡逆向移动。因此在灯管内的I2可循环使用。正确。B.WI4在灯管壁上分解,减少生成物的浓度,平衡正向移动,使灯管的寿命缩短。错误。C.WI4在灯丝上分解,分解产生的W及I2又沉积在灯丝上。正确。D.接通电源后,电能转化为热能,WI4的分解速率加快,W和I2的化合速率也加快。错误。
考点:考查化学平衡常数的表达式、化学平衡移动及物质的转化率的计算的知识。
本题难度:一般
4、选择题 下图是温度和压强对X+Y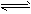 2Z反应影响的示意图。 图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 2Z反应影响的示意图。 图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
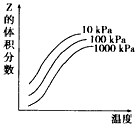
[? ]
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
参考答案:C
本题解析:
本题难度:一般
5、填空题 830K时,在密闭容器中发生下列可逆反应:

 CO(g)+H2O(g) CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题: CO2(g)+H2(g);△H<0 试回答下列问题:
 (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= . (1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
 (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。 (2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”), 此时v(正)正) v(逆)(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
 (3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。 (3)若降低温度,该反应的K值将 (均填“增大”“减小”或“不变”)。
参考答案:(1)平衡常数K= 1
(2) 否 大于
依据是Q="0.5×0.5/0.5×1.5" <1,即Q<K。所以未达平衡,V(正)>V(逆)
(3)增大
本题解析:(1)达到平衡时CO的转化率为60%,则生成CO2和氢气的浓度都是1.2mol/L,此时CO和水蒸气的浓度分别是0.8mol/L、1.8mol/L,所以该反应的平衡常数是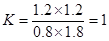 。 。
(2)反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时CO2也是0.5mol/L,而CO和氢气分别是0.5mol/L和1.5mol/L,所以有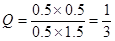 ,即Q<K。所以未达平衡,V(正)>V(逆)。 ,即Q<K。所以未达平衡,V(正)>V(逆)。
(3)正反应是放热反应,降低温度,平衡向正反应方向进行,所以平衡常数增大。
本题难度:困难
|  Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体
Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 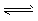 2NH3(g),加入HCl
2NH3(g),加入HCl 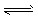 CaO(s)+CO2(g),加入CaCO3
CaO(s)+CO2(g),加入CaCO3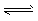 2SO3(g),加入N2
2SO3(g),加入N2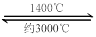 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。