微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ; 实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): ________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
参考答案:(10分)(方程式2分,其余1分)
(1)酸,<,Ag++ H2O  AgOH + H+,抑制。
AgOH + H+,抑制。
(2)酸,Al3++3H2O  Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3)NaOH
本题解析:(1)AgNO3为强酸弱碱盐,水溶液呈酸性,常温时的pH <7,原因是:Ag++ H2O  AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)氯化铝为强酸弱碱盐,水溶液呈酸性,其原因是:Al3++3H2O  Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
(3)硫化钠溶液为强碱弱酸盐,水溶液呈碱性,为了防止发生水解,可以加入少量的NaOH
本题难度:一般
2、选择题 下列能正确表示水解的离子方程式是
[? ]
A.CH3COOH + H2O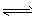 CH3COO- + H3O+
CH3COO- + H3O+
B.Br- + H2O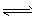 HBr + OH-
HBr + OH-
C.CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NH4+ + H2O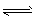 NH3·H2O + H+
NH3·H2O + H+
参考答案:D
本题解析:
本题难度:简单
3、填空题 下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。
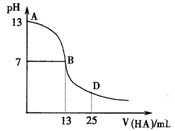
回答下列问题:
(1)上图能确定MOH为 (“强”或“弱”)碱,
理由是 。
(2)上图能确定HA为 (“强”或“弱”)酸,
理由是 。
(3)在D点时,溶液中c(A-)+c(HA) 2c(M+)。(填“>”、“<”或“=”)
参考答案:(1)强(2分);常温条件下水的离子积常数为10-14,0.1 mol·L-1 MOH溶液的pH=13,说明为强碱。(3分)[来源:91考试网ZXXK]
(2)弱(2分);若HA为强酸则在pH=7是刚好完全反应,体积消耗HA12.5mL,而现在是13ml,说明生成的强碱弱酸盐。(3分)
(3)=(3分)
本题解析:略
本题难度:困难
4、选择题 常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中
A.c(NH4+)<c(Cl-)
B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-)
D.无法确定c(NH4+)与c(Cl-)的关系
参考答案:B
本题解析:根据溶液的电中性可知c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),答案选B。
考点:考查溶液中离子浓度大小比较
点评:在判断离子浓度大小时,应该利用好电荷守、物料守恒和质子守恒等基本定律。
本题难度:简单
5、选择题 已知某溶液中存在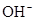 ,
,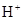 ,
,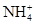 和
和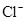 四种离子,其浓度大小有如下关系,其中可能的是( )
四种离子,其浓度大小有如下关系,其中可能的是( )
①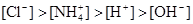 ②
②
③ 且
且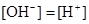 ④
④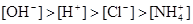
⑤
A.①④
B.③⑤
C.①②③
D.④⑤