微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30mL盐酸恰好完全反应。试求:
(1)该白色粉末灼烧后产生气体在标准状况下的体积?
(2)原混合物中各物质的质量。
(3)所用盐酸的物质的量浓度。
参考答案:(1)0.448L?(2) NaHCO3?3.36g? Na2CO3?1.06g?(3)2mol·L-1
本题解析:(1)产生的气体通入到澄清石灰水中产生2.00g沉淀,则n(CaCO3)=0.02mol,所以产生的CO2 0.02mol,体积为0.02mol×22.4L/mol=0.448L。
(2)2NaHCO3 Na2CO3+CO2↑+H2O,Na2CO3受热不分解,根据CO2为0.02mol可知NaHCO3为0.04mol则NaHCO3为0.04mol×84g/mol=3.36g。Na2CO3为4.42g-3.36g=1.06g。
Na2CO3+CO2↑+H2O,Na2CO3受热不分解,根据CO2为0.02mol可知NaHCO3为0.04mol则NaHCO3为0.04mol×84g/mol=3.36g。Na2CO3为4.42g-3.36g=1.06g。
(3)残渣能与30mL盐酸恰好完全反应为NaCl,根据原子守恒可知n(Na+)=n(Cl-),所以n(Cl-)="0.04mol+" 0.01mol×2=0.06mol。则c(HCl)=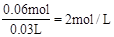
点评:本题非常简单基础,只要根据方程式进行计算即可。
本题难度:简单
2、选择题 将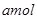 ?Na2O2和
?Na2O2和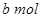 ?NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
?NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,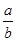 值可能为
值可能为
A.0.5
B.0.65
C.0.85
D.1.0
参考答案:D
本题解析:混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3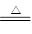 Na2CO3 + CO2↑+ H2O②2Na2O2+2CO2=2Na2CO3+O2
Na2CO3 + CO2↑+ H2O②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2 ④2NaOH+CO2=Na2CO3+H2O依题意可知,残余的固体为Na2CO3,生成的气体为O2和H2O(g),只发生反应①和②,a:b=1,选D。
本题难度:一般
3、选择题 1?mol过氧化钠与2?mol碳酸氢钠固体混合物,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
[? ]
A.Na2CO3?
B.Na2O2?Na2CO3
C.NaOH?Na2CO3?
D.Na2O2?NaOH?Na2CO3
参考答案:A
本题解析:
本题难度:一般
4、选择题 某烧碱溶液部分变质生成了少量纯碱,要除去此杂质需加适量的(?)
A.CaCl2溶液
B.Ca(OH)2
C.BaCl2
D.CO2
参考答案:B
本题解析:除杂的原则之一:不能引入新杂质。A、C选项均引入Cl-,D选项中CO2,还能与NaOH反应。
本题难度:简单
5、选择题 可以用来鉴别Na2CO3溶液和NaHCO3溶液最好的是
A.加CaCl2溶液
B.加热
C.加稀盐酸
D.加澄清的石灰水
参考答案:A
本题解析:鉴别效果应从操作的简易程度及现象是否明显来判定
加热操作较麻烦,排除;两溶液均可与澄清石灰水生成白色沉淀,排除;
两者均可与盐酸产生气体,排除,故答案为A:前者可产生白色沉淀,而后者无现象
本题难度:一般