微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (18分)
Ⅰ已知:Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号
| 反应温度/℃
| Na2S2O3溶液
| 稀H2SO4
| H2O
|
V/mL
| c/(mol/L)
| V/mL
| c/(mol/L)
| V/mL
|
①
| 20
| 10.0
| 0.10
| 10.0
| 0.50
| 0
|
②
| 40
| V1
| 0.10
| V2
| 0.50
| V3
|
③
| 20
| V4
| 0.10
| 4.0
| 0.50
| V5
|
(1)该实验①、②可探究 对反应速率的影响,因此V1= ,V2= ;V3= ;
(2)实验①、③可探究 对反应速率的影响,因此V4= ,V5= ;
(3)下列有关该的相关叙述正确的是
A.实验前,应先在一张白纸上用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3 和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
D.每组实验至少需要两支量筒
(4)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小? 。
Ⅱ利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可以定量测定市售硫代硫酸钠(Mr=158)的纯度,现在称取Wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用含有I2为amol/L的碘水滴定,消耗碘水bmL,则:
(1)验过程中滴定管应该选择的是 (酸式或碱式)滴定管,滴定前可以选择 做指示剂,滴定终点的现象为
(2)对于该滴定实验的有关操作或误差分析正确的是 。
A.滴定前,应对滴定管、锥形瓶进行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得的纯度将会偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
(3)样品中硫代硫酸钠纯度的表达式为 。
参考答案:Ⅰ(10分)
(1)温度(1分); 10.0,10.0,0(全对2分)
(2)浓度(或写c(H+))(1分); 10.0,6.0(全对2分)
(3)AD(2分)
(4)SO2易溶于水,无法准确测量其体积(2分)
Ⅱ(8分)
(1)酸(1分);淀粉(1分)溶液刚好出现蓝色,且半分钟不褪去(2分)
(2)BD(2分)
(3) (2分)
(2分)
本题解析:Ⅰ、(1)由表中所给数据可知:实验①、②温度不同故实验①、②则是探究温度对反应速率影响,故V1=10.0ml, V2=10.0ml; V3=0ml;(2)实验①、③温度相同,所取稀硫酸量不同,故实验①、③则是探究c(H+)对反应速率影响,故V4=10.0ml, V5=6.0ml;(2) A.实验前,应先在一张白纸上用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间,由时间可以判断反应速率,故A项正确;B.该实验所需的计量仪器有量筒、温度计,还应有秒表,故B项错误;C.实验时,应先将量取的Na2S2O3 和H2SO4溶液混合,混合后两者即已开始反应,故不应两者混合,应用分液漏斗逐滴添加,然后置于相应温度的热水浴中反应,记录每组反应所需时间,故C项错误;该实验要分别量取Na2S2O3溶液和稀H2SO4的体积,故本实验应用到两只量筒,故D项正确;本题选AD;(4)该反应产生的SO2气体易溶于水,故不能用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小;Ⅱ、(1)碘水呈酸性,故应用酸式滴定管;淀粉遇碘变蓝,故应用淀粉作指示剂;滴定终点现象为:溶液刚好出现蓝色,且半分钟不褪去;(2)A项锥形瓶不应润洗,若用待装液润洗,则会导致消耗碘水体积偏大,故所配溶液浓度偏大,故A项错误;B.滴定过程中,标准液滴到锥形瓶外,则会导致所读体积偏大,会使所测结果偏大,故B项正确;C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则会使消耗溶液体积偏大,故会使最终结果偏高,故C项错误;D.滴定前仰视读数而滴定结束时俯视读数,则会导致滴定所读数据偏小,故会导致所得结果偏低,故D项正确;本题选BD;(3)由题中所给数据可知样品中硫代硫酸钠纯度的表达式为 。
。
考点:化学综合实验。
本题难度:困难
2、填空题 (16分) 已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a b(填“>、=、<”)
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。若将反应容器的体积压缩,平衡向 方向移动(填“正反应”或”逆反应”),该反应的平衡常数将 。(填“增大”“减小”或“不变”)
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达平衡后,吸收热量ckJ,C3的浓度也是w mol/L,则c 等于 (用a、b表示)。
(4)能说明该反应已经达到平衡状态的是
A 2v逆(A2)=v正(B2) B v正(C3)=2v正(B2)
C A2与C3浓度相等 D.混合气体的平均相对分子质量不变
E.容器内压强保持不变 F.容器内密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A2和1molB2,500 ℃时充分反应达平衡后,放出热量dkJ,则d b(填“>、=、<”)
(7)下图表示此反应的反应速率v和时间t的关系图。
根据下图判断,在t1和t4时刻改变的外界条件分别是 和 。

参考答案:27.((1)(2)每空1分,其余每空2分,共16分)
(1)> (2)减小,正反应,不变(3)a-b (4) D E(少选得1分,多选不得分);
(5)C (6)> (7)升高温度,降低压强
本题解析:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,没有完全反应,即释放的热量小于完全反应释放的热量,即b<a,(2)常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小,若将反应容器的体积压缩,即增大压强,平衡向正反应方向移动,因为影响化学平衡常数的因素只有温度,所以该反应的平衡常数不变。(3)相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2建立完全相同的平衡状态,即等效平衡,C3="w" mol/L,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,由于等效平衡的正逆反应转化率之和等于1,则b+c=a,C=a-b,(4)2v逆(A2)=v正(B2),表示的是正逆反应速率,但是不满足化学计量数的关系,正逆反应速率不相等,没有达到平衡状态,A错误;反应中表示的都是正反应速率,无法判断正逆反应速率是否相等,B错误;A2与C3浓度相等,应该是浓度保持不变,C错误;混合气体的平均相对分子质量=m/n,随着反应的进行,气体的物质的量逐渐减小, 混合气体的平均相对分子质量不变,说明达到平衡,D正确;由于反应两边气体的分子数发生改变,反应中压强改变,所以压强不变能判断反应是否达到了平衡状态,E正确;反应方程式两边气体的质量相等,容器的容积固体,根据密度ρ=m/v,可见密度是个常量,始终都不发生变化,F错误。(5)为使该反应的反应速率增大,可以B.适当升高温度C.增大B2的浓度D.选择高效的催化剂,为使平衡向正反应方向移动,可以A.及时分离出C3气体C.增大B2的浓度,综上所述为使该反应的反应速率增大,且平衡向正反应方向移动的是C。(6)由于给定反应是一个气体体积减小的反应,恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,放出热量增多,d>b;(7)根据图像可知,t1时刻,正逆反应速率都增大,且逆反应速率增幅大,所以一定是升高温度,t4时刻,正逆反应速率都减小,且正反应速率减幅大,所以一定是降低压强。
考点:考查化学平衡的影响因素,化学平衡的建立过程,化学平衡状态的判断。
本题难度:困难
3、选择题 为了探究温度对化学反应速率的影响,下列实验方案可行的是
[? ]
A.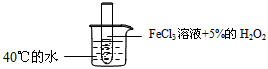
B.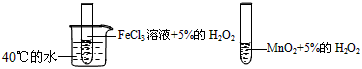
C.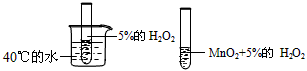
D.
参考答案:D
本题解析:
本题难度:一般
4、简答题 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL?0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:
(1)曲线OA段不产生氢气的原因是______,有关的离子反应方程式为______;
(2)曲线BC段产生氢气的速率突然加快的主要原因是______;
(3)点C以后产生氢气的速率逐渐减小的主要原因是______;
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)______.
参考答案:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝和稀硫酸反应生成氯化铝和水,所以离子方程式为Al2O3+6H+=2Al3++3H2O;
故答案为:硫酸首先与铝片表面的Al2O3反应;?Al2O3+6H+=2Al3++3H2O;
(2)金属和酸的反应是放热反应,所以该反应放热,使溶液的温度升高,升高温度,化学反应速率加快.
故答案为:由于反应放出的热量使溶液温度升高而使反应速率加快了;
(3)随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小;
故答案为:随着反应的进行,硫酸溶液的浓度逐渐下降;
(4)设稀硫酸完全反应需要金属铝xg.
2Al+3H2SO4=Al2(SO4)3+3H2↑
54g? 3mol
xg? 0.5L×0.5mol/L
所以x=4.5<5,故金属铝过量,应以稀硫酸为标准计算生成的氢气体积.
设生成氢气的体积为y.
2Al+3H2SO4=Al2(SO4)3+3H2↑
?3mol? 67.2L
?0.5L×0.5mol/L?y
y=5.6L?
故答案为:5.6?L.
本题解析:
本题难度:一般
5、选择题 在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是(?)
A.2NO+O2  2NO2
2NO2
B.N2O4 2NO2
2NO2
C.Br2(g)+H2 2HBr
2HBr
D.6NO+4NH3 5N2+3H2O
5N2+3H2O
参考答案:C
本题解析:本题考查平衡的移动。改变压强时,颜色也会改变,但平衡并不移动,表明该反应是气体计量数不变的反应,只能是C,而且保持温度一定时,改变任何物质的浓度,混合气体的颜色都会改变。
本题难度:简单