微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图表示反应

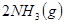 ;
;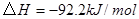 。在某段时间
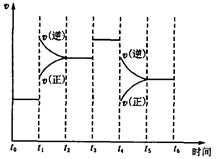
。在某段时间 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
A.
B.
C.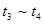
D.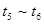
参考答案:A
本题解析: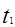 时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。
时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。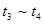 平衡没有发生移动。
平衡没有发生移动。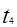 之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
本题难度:一般
2、选择题 硫代硫酸钠与稀盐酸的反应Na2S2O3+2HCl→2NaCl+S↓+SO2↑+H2O在加热条件下反应速度加快,原因主要是
A.该反应是吸热反应,且可逆,加热使平衡向正向移动
B.加热促使SO2逸出,使平衡向正向移动
C.加热促进S2O32-与H+的碰撞,使反应加速
D.加热促进Na+与Cl-的碰撞,使反应加速
参考答案:C
本题解析:温度升高,反应速率加快的原因是增加了反应微粒的碰撞几率和活化分子的百分含量,C正确。
本题难度:一般
3、选择题 下列实验事实不能用平衡移动原理解释的是( )
A.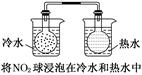
B.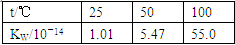
C.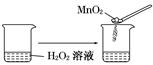
D.
参考答案:C
本题解析:本题考查化学平衡移动原理及化学反应速率的影响因素,意在考查考生对相关知识的掌握情况。选项A可以用温度变化来解释化学平衡的移动,A项正确;选项B说明离子积随着温度的升高而增大,即温度升高,水的电离平衡正向移动,B项正确;选项C是催化剂对化学反应速率的影响,与化学平衡无关,C项错误;选项D中浓度与溶液pH的关系说明浓度对NH3·H2O的电离平衡的影响,D项正确。
本题难度:一般
4、选择题 下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KCl03,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
参考答案:A.在炭粉中加入KCl03,点燃时燃烧更为剧烈,是因为氯酸钾分解产生氧气,增大了氧气的浓度,故反应速率加快,故A不符合;
B.H2O2中加入少量MnO2,即可迅速放出气体,是因为MnO2为催化剂,加快了过氧化氢的分解,故B符合;
C.将炭块粉碎成粉末状,可使燃烧更加充分,是增大了接触面积,反应速率加快,故C不符合;
D.电解水时,加少量硫酸可使电解速率加快是因为硫酸是强电解质能增强水的导电能力,故D不符合;
故选B
本题解析:
本题难度:一般
5、选择题 把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是
[? ]
A.盐酸的浓度
B.铝条的表面积
C.溶液的温度
D.加少量Na2SO4
参考答案:D
本题解析:
本题难度:一般