微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 试试看,你能用化学方程式解释下列现象吗?
(1)氢氟酸可用于雕刻玻璃:________________________。
(2)氢氧化钠等碱性溶液不能存放在磨口玻璃塞的试剂瓶中: _______________________。
(3)硅酸钠溶液暴露在空气中易变质:___________________________。
参考答案:(1)SiO2+4HF = SiF4↑+2H2O
(2)SiO2+2NaOH = Na2SiO3+H2O
(3) Na2SiO3+H2O+CO2 = H2SiO3↓+Na2CO3
本题解析:
本题难度:一般
2、填空题 工业上以铝土矿(主要成分是A12O3,含杂质Fe2O3和SiO2)为原料生产铝,其生产流程如下:
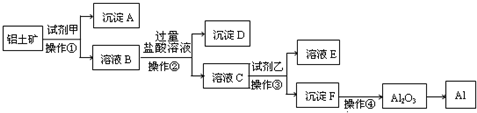
请回答:
(1)工业上Al2O3?冶炼Al所采用的方法是______,化学方程式______
(2)加入试剂甲后发生反应的离子方程式有两个,一是______,二是______.
(3)在溶液B中加入过量盐酸溶液的目的是______.
(4)加入试剂乙后发生反应的离子方程式______.
(5)铝与氢氧化钠溶液反应的离子方程式为______.
参考答案:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,该工艺流程原理为:铝土矿加入氢氧化钠,滤液C中含有偏铝酸根离子、硅酸根离子,A沉淀为氧化铁,B溶液中加过量盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入滤液C,沉淀D为硅酸,试剂乙为氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,
(1)工业上利用电解熔融的Al2O3?生成Al与氧气,以此冶炼金属Al,反应方程式为2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑,
故答案为:电解熔融的Al2O3,2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑;
(2)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-═SiO32-+H2O,
氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O,Al2O3+2OH-═2AlO2-+H2O;
(3)由工艺流程可知,B溶液中加过量盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入滤液;
故答案为:除去硅酸根离子,将偏铝酸根离子转化为铝离子;
(4)氨水与铝离子反应生成氢氧化铝沉淀,反应离子方程式为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+;
(5)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
本题解析:
本题难度:一般
3、填空题 近日,“杭州创造”首届十大创新成就评选发布晚会上,浙江省富通集团光纤预制棒项目赢得十大创新成就殊荣。光纤预制棒是光缆生产的最“源头”项目,目前国内光缆生产厂家约200家,大部分靠买进口光纤预制棒来生产光缆。
(1)光纤预制棒的化学成分是___________,晶体类型为__________。
(2)如果把光缆裸露在碱性土壤中,结果会短路,用离子方程式说明原因__________________。
(3)下列说法正确的是_______
A、石英玻璃与普通玻璃都是硅酸盐制品
B、二氧化硅是良好半导体材料
C、工艺师用盐酸刻蚀石英制作艺术品
D、石英与二氧化碳化学键相同
(4)石英可以制备各种各样的陶瓷制品,如坩埚、蒸发皿、氮化硅高温结构陶瓷等。写出氮化硅的化学式__________,工业上用石英、焦碳、氮气制备氮化硅,写出反应方程式___________________。
(5)晶体硅是电子工业的重要材料,工业上大量的晶体硅是由石英为原料制备得到的。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3;
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
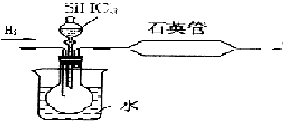
其中用SiHCl3与过量H2反应制备纯硅的装置如下(热源装置略去):
为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。装置C中的烧瓶需要加热,其目的是:_______________。装置D中发生反应的化学方程式为____________________。
参考答案:(1)SiO2;原子晶体
(2)SiO2 + 2NaOH = Na2SiO3 + H2O
(3)D
(4)Si3N4; 3SiO2 + 2N2 + 6C = Si3N4 + 6CO
(5)排尽装置中的空气;使滴入烧瓶中的SiHCl3气化;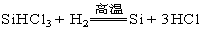
本题解析:
本题难度:一般
4、简答题 碳、硅同为周期表中ⅣA族的元素,是构成自然界各种物质的重要元素.
(一)由碳元素构成的各种单质和化合物都是科学家研究的重要对象.
(1)用特殊方法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下方法提纯,请配平该反应的化学方程式:
______C+______KMnO4+______H2SO4→______CO2↑+______MnSO4+______K2SO4+______H2O
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+
O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
| 容器编号 | c(CO)/mol?L-1 | c(O2)mol?L-1 | c(CO2)mol?L-1 | v(正)和v(逆)比较
Ⅰ
2.0×10-4
4.0×10-4
4.0×10-2
v(正)=v(逆)
Ⅱ
3.0×10-4
4.0×10-4
5.0×10-2
v(正)______v(逆)
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol/L和1.0×10-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为______mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______.
(二)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用过量的碳还原二氧化硅制得粗硅
②粗硅与干燥的HCl气体反应制得SiHCl3
③SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,已知SiHCl3能与水强烈反应,在空气中易自燃.请回答:
(1)第一步制取粗硅的化学方程式______.
(2)粗硅与HCl反应制备三氯氢硅的过程中发生反应的热化学方程式为:
(i)Si(s)+3HCl(g)═SiHCl3(g)+H2(g)△H=-210kJ/mol
(ii)Si(s)+4HCl(g)═SiCl4(g)+2H2(g)(副反应)△H=-241kJ/mol
①常温下,SiHCl3和SiCl4均为液态化合物,二者互溶且均易水解,则分离二者的最佳方法是______.
②某反应的能量变化如图所示:则该反应的能量变化E=______kJ.
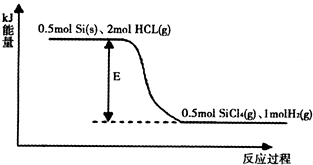
③SiCl4可转化为SiHCl3而循环使用,则该反应的热化学方程式为:______.
参考答案:(一)(1)高锰酸钾中锰元素化合价降低7-2=5价,碳元素化合价升高4-0=4价,化合价升高数=化合价降低数,所以高锰酸钾前的系数 是4,碳单质前的系数是5,根据原子守恒,二氧化碳前是5,硫酸锰前是4,硫酸钾前面是2,根据硫酸跟守恒,所以硫酸前面是6,据氧原子和氢原子守恒,产物少6个水分子,
故答案为:5;4;6;5;4;2;6;
(2)①由Ⅰ可求K=4.0×10-2mol/L2.0×10-4mol/L×
本题解析:
本题难度:简单
5、选择题 信息高速公路的骨架是光导纤维,它的主要成分是( )
A.Si
B.SiO2
C.H2SiO3
D.Na2SiO3
参考答案:A.硅常用于半导体材料,故A错误;
B.光导纤维的主要成分是二氧化硅,故B正确;
C.硅酸常用于制备硅胶,用作干燥剂或催化剂的载体,故C错误;
D.硅酸钠常用于防火剂,故D错误.
故选B.
本题解析:
本题难度:简单