微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是
[? ]
A.它们分别与足量CaCO3反应时,放出的CO2一样多
B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
C.两种溶液的pH相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
参考答案:A
本题解析:
本题难度:一般
2、选择题 把0.05mol醋酸分别加入到下列100 mL溶液中,溶液的导电能力变化最明显的
A.0.5 mol/LNaOH溶液
B.0.5 mol/L盐酸
C.0.5 mol/L NH4Cl溶液
D.0.5 mol/L 氨水
参考答案:D
本题解析:正确选项为D,醋酸为弱电解质,氨水中的一水合氨也为弱电解质,当两者混合后生成强电解醋酸铵,溶液的导电能力会增大,溶液的导电能力变化最明显
本题难度:一般
3、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。

若在恒温、恒压条件下向平衡体系中通入氯气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的△H(填“增大”“减小”或“不改变”)。
(2)已知:
O2(g)=O2+(g)+e- △H1=1175. 7 kJ/mol
PtF6(g)+e-=PtF6-(g) △H2=-771. l kJ/mol
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482. 2 kJ/mol
则反应O2(g) +PtF6(g)=O2+PtF6-(s)的△H=___________kJ/mol
(3)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuC12混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时,Ksp[Mg(OH)2] =1.8×
10-11 ksp[Cu(OH)2] =2.2×l0-20
(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
____________。
参考答案:(1)向左;不改变
(2)-77.6
(3)Cu(OH)2;Cu2++ 2NH3·H2O==Cu(OH)2↓+2NH4+
(4)中;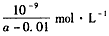
本题解析:
本题难度:困难
4、选择题 下列实验,不能说明乙酸是弱电解质的是
A.常温时,测得乙酸钠溶液的pH>7
B.常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C.乙酸溶液与大理石反应产生气泡
D.相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
参考答案:C
本题解析:A、乙酸钠溶液的pH>7 说明乙酸根离子是弱离子水解,正确; B、乙酸部分电离出氢离子,是弱电解质,正确;C、酸的性质,错误;D、导电能力强溶液中离子浓度大,说明乙酸没能完全电离,正确。
本题难度:一般
5、选择题 甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1
B.甲酸能与水以任意比互溶
C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应
D.滴入石蕊试液显红色
参考答案:A
本题解析:弱电解质的本质特征就是在水溶液中部分电离:A中c(H+)="0.01" mol·L-1,可以说明这一点。B中说明甲酸的溶解性;C说明酸跟碱反应的能力;D说明甲酸显酸性;B、C、D都不能说明甲酸是弱电解质。
本题难度:一般