|
|
|
高中化学知识点归纳《热化学方程式》高频试题强化练习(2017年最新版)(六)
2017-03-05 16:01:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在25 ℃时:2C(s)+O2(g)=2CO(g) △H1=-222 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394 kJ/mol
则25 ℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热 △H4为
A.-82 kJ/mol
B.-41 kJ/mol
C.-312 kJ/mol
D.+82 kJ/mol
|
参考答案:B
本题解析:根据所给热化学方程式,依据盖斯定律③—①×1/2—②×1/2得CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4=△H3—1/2△H2—1/2△H1=-41kJ/mol,选B。
考点:考查盖斯定律的应用。
本题难度:一般
2、填空题 X、Y、Z、W是短周期中常见元素,其相关信息如下表:
元素
| 相关信息
| X
| X元素形成的一种同素异形体是天然晶体中硬度最大的单质
| Y
| 常温常压下,Y单质是淡黄色固体,用于制造黑火药
| Z
| Z的基态原子核外有3个能级上有电子,且有3个单电子
| W
| W元素形成的双原子分子,常温下为黄绿色气体,一种常见工业原料
|
(1)W元素位于元素周期表中第 周期 族,与Y同主族且位于第四周期元素的基态原子核外电子排布式为 。
(2)XY2分子中含有的σ键和π键个数比为 ,在相同条件下XY2与XO2相比,熔点较高的是 (填化学式)。结合相关理论解释Z所在族的元素第一电离能大于同周期后一族元素的原因: 。
(3)Y、W元素形成的化合物Y2W2和过量氢化物ZH3在无水条件下反应生成Y4Z4、单质Y8和一种可以作为化肥的物质,请写出相应化学方程式: 。
(4)已知:①lmolY(s)转化为气态Y(g) 吸收能量280 kJ;
②2XO(g)+O2(g)= 2XO2(g) ΔH=-566.0KJ/mol;
③Y(s)+O2(g)=YO2(g) ΔH=-299.0KJ/mol;一定条件下,可以利用X的氧化物XO和Y的氧化物YO2生成Y(g)单质和X的氧化物而达到消除污染目的。请写出该反应的热化学方程式: 。
参考答案:(共13分)
(1)三、VⅡA(2分) 1s22s22p63s23p63d104s24p4(或[Ar]3d104s24p4)(2分)
(2)1:1(1分) CS2(1分)
由于N元素昕在的第VA族,p能级上处于半充满,符合洪特规则中半满为稳定结构,所以第一电离能大于同周期后一主族元素(2分)
(3)6S2Cl2+16NH3=S4N4+S8+12NH4C1(2分)[化学式或配平错误0分]
(4)2CO(g)+SO2(g)=2CO2(g)+S(g) △H="+10.0" KJ/mol(3分)[化学式或配平错误0分,状态或热值错扣2分]
本题解析:由题意可以推出X、Y、Z、W分别为C、S、N、Cl。
(1)Br的电子排布式,可由其为P区,第三周期全部排满,可以写出;
(2)CS2与CO2类似,为S=C=S结构;分子晶体熔沸点比较,如果结构相似,相对分子质量越大,分子间作用力越大,熔沸点越高;N为半充满状态,故第一电离能高于O。
(3)根据反应物为S2Cl2和NH3,生成物为S4N4和S8,根据质量守恒可以写出反应方程式。
(4)目标反应为2CO(g)+SO2(g)=2CO2(g)+S(g);根据盖斯定律,其为②-③+①,故得到该热化学方程式。
考点:考查物质结构基础知识,涉及原子结构、分子结构、晶体结构以及氧化还原反应、热化学反应方程式的书写等相关知识。
本题难度:困难
3、简答题 氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)工业合成氨的热化学方程式:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ/mol.有关键能:
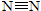
:946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为______.
(2)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:已知1molH2O(g)转变为1molH2O(l)时放热44.0KJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式______.
| 物质 | △H(KJ/mol)
H2(g)
-285.8
CO(g)
-283.0
CH4(g)
-890.3
|
(3)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是______,溶液中离子浓度从大到小的顺序是______.
参考答案:(1)因反应热等于反应物的总键能减去生成物的总键能,设H-H键能为 xKJ/mol,则
?945.6kJ/mol+3xKJ/mol-6×391.0kJ/mol=-92.2kJ/mol? 解得x=436.1,
?故答案为:436.1kJ/mol;
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol? ①
? H2(g)+12O2(g)═H2O(l)△H=-285.8KJ/mol? ②
? CO(g)+12O2(g)═CO2(g)△H=-283KJ/mol? ③
? ?而H2O(g)═H2O(l)△H=44.0kJ/mol?④
根据盖斯定律:④+①-②×3-③,得
CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=44KJ/mol-890.3KJ/mol+285.8KJ/mol×3+283KJ/mol=+206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol;
(3)6.72L即0.3mol氨气通入到100g19.6%即0.2mol的硫酸溶液中:NH3+H2SO4=NH4HSO4,生成0.2molNH4HSO4,NH3过量0.1mol,与NH4HSO4反应:NH3+NH4HSO4=(NH4)2SO4,生成0.1mol(NH4)2SO4,过量0.1molNH4HSO4,所以溶质为NH4HSO4、(NH4)2SO4,NH4HSO4能电离出等量的铵根、氢离子和硫酸根,(NH4)2SO4电离出铵根、硫酸根,虽然铵根离子水解,但浓度最大,故答案为:NH4HSO4、(NH4)2SO4;c(NH+)>c(SO42-)>c(H+)>c(OH-).
本题解析:
本题难度:一般
4、填空题 (17分)针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。
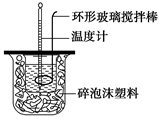
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)。
H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
参考答案:
本题解析:
本题难度:一般
5、填空题 (18分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用研究。
(1)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是___ _(填序号)。
A.烷烃
B.烯烃
C.炔烃
D.苯的同系物
|
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,
一定条件下发生反应:CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H=-49.0 kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

的转化率=
;能使平衡体系中n(CH3OH)增大的措施有
。
(2)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
己知:①CH4(g)+2O2(g)=CO2(g)+2H2O( l ) △H=-890.3kJ/mol
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
。
(3)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式
。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
溶解度(s)/g
| 溶度积(Ksp)
|
Ca(OH)2
| Ba(OH)2
| CaCO3
| BaCO3
|
0.16
| 3.89
| 2.9×10-9
| 2.6×10-9
|
吸收CO2最合适的试剂是__
__(填“Ca(OH)2”或“Ba(OH)2”)溶液。
参考答案:(1)①B;② 平衡常数表达式K= ;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
(2)CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol
(3)CH3OH-6e-+8OH-= CO32-+6H2O; 1.2mol ;(4)Ba(OH)2 。
本题解析:(1)如将CO2与H2以1:3的体积比混合。①适当条件下合成某烃和水,根据质量守恒定律可得:2CO2+6H2=C2H4+4H2O所以该烃是烯烃,选项是B;②反应CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)的平衡表达式是K= 。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
考点:考查物质的火车产物、化学平衡常数的表达式、化学反应速率和物质的转化率的计算、热化学方程式的书写、燃料电池的反应原理、电子转移及气体吸收试剂的选择的知识。
本题难度:一般

 ;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等;
;v(H2)=0.225 mol/(L·min); 75%;降低温度或加压或增大H2的量等; 。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。
。v(H2) :V(CO2)="3:1," V(CO2)=0.75mol/L÷10min=0.075mol/(L·min),所以v(H2) ="3" V(CO2)=" 3×0.075mol/(L·min)=" 0.225 mol/(L·min);从反应开始至平衡,CO2改变浓度是0.75mol/L,则H2改变浓度是2.25mol/L,所以氢气的转化率=(2.25mol/L÷3mol/L)×100%=75%;若使平衡体系中n(CH3OH)增大,则应该使平衡正向移动。根据平衡移动原理,可知采取的措施有降低温度或加压或增大H2的量等;(2)②×2—①,整理可得:CO2(g) + 4H2(g) ==CH4(g)+ 2H2O(l) ΔH=-253.9kJ/mol;(3)以氢氧化钾为电解质的甲醇燃料电池中,通入甲醇的电极是负极,负极反应式是CH3OH-6e-+8OH-= CO32-+6H2O; n(O2)= 6.72L÷22.4L/mol=0.3mol。由于在氧化还原反应中电子转移数目相等。所以n(e-)=0.3mol×4=1.2mol。(4)由于CaCO3、BaCO3的溶度积常数相差不大,而物质的溶解度:Ca(OH)2的溶解度小于Ba(OH)2,所以吸收CO2最合适的试剂是Ba(OH)2溶液。