微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列分离提纯各混合物的方法正确的是
[? ]
①二氧化硅中混有碘(萃取、分液)
②四氯化碳中混有少量水(分液)
③酒精中含有少量水(加 生石灰后蒸馏)
④硝酸钾中含有少量碳酸钙(溶解、过滤、浓缩、结晶)
⑤乙酸乙酯中混有少量乙酸(加饱和碳酸钠溶液,分液)
⑥铁粉中混有少量铝粉(加适量盐酸后,过滤)
A.①②③⑥
B.②③⑤⑥
C.②③④⑤
D.全部
参考答案:C
本题解析:
本题难度:一般
2、选择题 在相同条件下,A容器中的O2和B容器中的NH3所含的原子总数相等,则两个容器的体积比为
A.1∶2
B.1∶3
C.2∶3
D.2∶1
参考答案:D
本题解析:
本题难度:困难
3、选择题 下列四种化学操作名称从左到右分别是
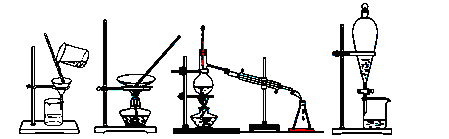
A.过滤、蒸发、蒸馏、萃取分液
B.过滤、蒸馏、蒸发、萃取分液
C.蒸发、蒸馏、过滤、萃取分液
D.萃取、蒸馏、蒸发、过滤分液
参考答案:A
本题解析:四种化学操作名称从左到右分别是过滤、蒸发、蒸馏、萃取分液,故选A。
点评:本题考查物质的分离,题目难度不大,要明确各种分离的方法及其适用范围,做题时注意把握物质的性质和分离的原理。
本题难度:简单
4、简答题 电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质.

已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈______性(“酸”、“碱”、“中”)
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式
______Cr(OH)3+______Na2CO3+______=______Na2CrO4+______CO2+______
(3)滤渣II的主要成分有Zn(OH)2、______
(4)“系列操作”中为:继续加入H2SO4,______冷却结晶,过滤.继续加入H2SO4目的是______.
已知:①除去滤渣II后,溶液中存在如下反应:2C
+2H+?C+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
温度
化学式 | 20℃ | 60℃ | 100℃
Na2SO4
19.5
45.3
42.5
Na2Cr2O7
183
269
415
Na2CrO4
84
115
126
|
(5)工业上还可以在水浸过滤后的溶液Na2CrO4加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式______.
参考答案:(1)水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等都为强碱弱酸盐,水解呈碱性,故答案为:碱性;
(2)氧化焙烧过程中有氧气参加反应,根据质量守恒可知还应生成水,反应的方程式为4Cr(OH)3+4Na2CO3+3O2=4Na2CrO4+4CO2+6H2O,
故答案为:4Cr(OH)3+4Na2CO3+3O2=4Na2CrO4+4CO2+6H2O;
(3)Zn(OH)2、Al(OH)3具有两性,水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质,加入硫酸调节溶液的pH可得到Zn(OH)2、Al(OH)3沉淀,
故答案为:Al(OH)3;
(4)水浸后溶液中存在Na2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,加入硫酸可使平衡向正反应方向移动,将溶液蒸发浓缩、冷却结晶可得到晶体,
故答案为:蒸发浓缩;促进平衡CrO42-+2H+?Cr2O72-+H2O向正反应方向移动,尽可能生成更多溶解度更大的Na2Cr2O7;
(5)生成铬的电极发生还原反应,CrO42-得到电子生成Cr,反应的电解方程式为CrO42-+8H++6e-=Cr+4H2O,
故答案为:CrO42-+8H++6e-=Cr+4H2O.
本题解析:
本题难度:一般
5、选择题 VL硫酸铁溶液中含有mgFe3+离子,则溶液中SO42-离子的物质的量浓度是
A.mol/L
B.mol/L
C.mol/L
D.mol/L
参考答案:A
本题解析:分析:根据n=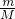 铁离子的质量计算铁离子的物质的量,根据化学式可知硫酸根离子的物质的量为铁离子的
铁离子的质量计算铁离子的物质的量,根据化学式可知硫酸根离子的物质的量为铁离子的 倍,根据c=
倍,根据c=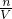 计算SO42-浓度.
计算SO42-浓度.
解答:mgFe3+离子的物质的量为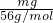 =
=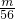 mol,
mol,
根据Fe2(SO4)3的化学式可知:n(SO42-)= n(Fe3+)=
n(Fe3+)= ×
×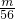 mol=
mol=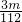 mol,
mol,
则溶液中SO42-的物质的量浓度为c=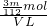 =
=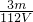 mol/L.
mol/L.
故选:A.
点评:考查物质的量浓度的计算,难度不大,注意化学式的组成和有关物质的量的计算公式的运用.
本题难度:简单